
题目列表(包括答案和解析)
25. (9分)应用化学反应需要研究化学反应的条件、限度和速率。
(1)773 K、固定体积的容器中,反应CO(g)+2H2(g)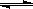 CH3OH(g)过程中
CH3OH(g)过程中
 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
① 若按上述投料比使该反应具有工业
应用价值,CO的平衡转化率最小为 ; ②在容器容积不变的前提下,欲提高H2
的转化率,可采取的措施(答两项即可)
、 ;
③下列与催化剂有关的说法中,正确的是 (填字母序号)。
a.使用催化剂,使反应 CO(g)+2H2(g)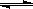 CH3OH(g) ΔH>-91 kJ·mol-1
b.使用催化剂,能够提高反应物转化率
CH3OH(g) ΔH>-91 kJ·mol-1
b.使用催化剂,能够提高反应物转化率
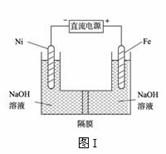
c.使用催化剂,不能改变反应的平衡常数K (2)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图I所示。
①Fe电极作 极(填“阴”或“阳”);
②Ni电极的电极反应式为: 。
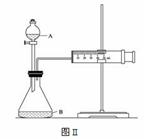
(3)欲用下图II装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、 用量及其他影响速率的条件确定之后,可以通过测定
用量及其他影响速率的条件确定之后,可以通过测定
推算反应速率。
24. (8分)工业上合成氨是在一定条件下进行如下反应:
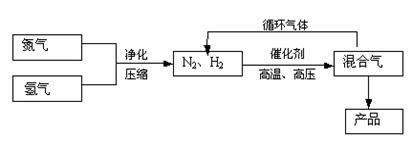 N2(g)+3H2(g)
N2(g)+3H2(g) 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,
K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
23.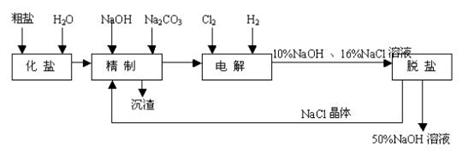 (10分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
(10分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
,
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
(选填a、b、c,多选扣分)
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
(选填a,b,c多选扣分)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(4)电解过程的总反应方程式为 。 (5)电解槽阳极产物可用于
(至少写出两种用途)。
22. (8分)80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
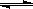 2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
N(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为 mol·L-1·s-1
(2)计算在80℃时该反应的平衡常数K= ; (3)要增大该反应的K值,可采取的措施有(填序号) ;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
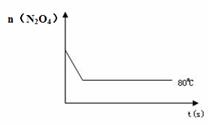 (4)如右图是80℃时容器中N2O4物质的量的变
(4)如右图是80℃时容器中N2O4物质的量的变
化曲线,请在该图中补画出该反应在60℃时N2O4
物质的量的变化曲线。 三、化学工业(2题,18分)
21.(6分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁
年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极: ;负极: 。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,
其中焊接在铁闸门的固体材料R可以采用 。(请写出具体金属名称)
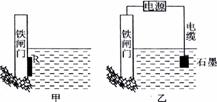 (3)右图中乙方案也可降低铁闸门腐
(3)右图中乙方案也可降低铁闸门腐
蚀速率,其中铁闸门应该连接在直流电源
的 极。
20.已知下列热化学方程式,且b> a 。
Hg(l)+1/2O2(g)=HgO(s) △H =-a kJ·mol-1
Zn(s)+1/2O2(g)=ZnO(s) △H =-b kJ·mol-1
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为
A.-(b-a) kJ·mol-1 B.+(b-a) kJ·mol-1
C.(b-a) kJ·mol-1 D.(b+a) kJ·mol-1
第II卷 非选择题(50分)
19.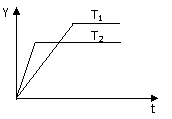 已知反应:N2(g)+3H2(g)
已知反应:N2(g)+3H2(g) 2NH3(g) △H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化示意图,Y可以是
2NH3(g) △H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化示意图,Y可以是
A.N2的转化率 B.混合气体的密度
C.H2的体积百分含量 D.密闭容器内的压强
18.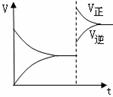 右图是反应A2(g)+3B2(g)
右图是反应A2(g)+3B2(g) 2C(g)△H<0
2C(g)△H<0
的平衡移动图,影响该反应平衡移动的原因是
A.升高温度 B.增大反应物浓度
C.增大压强 D.使用催化剂
17.下列事实,不能用勒夏特列原理解释的是
A.实验室用排饱和食盐水而不用排水法收集氯气
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
D.光照新制的氯水时,溶液中c(H+)增大
16.高温下,某反应达平衡,平衡常数K= , 恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值 B.恒温恒容下,增大压强, H2 浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为 CO + H2O CO2 +
H2
CO2 +
H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com