
题目列表(包括答案和解析)
6.下列说法正确的是
A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大
B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2
C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的c(H+)之比为10:1
5.下列实验操作中所用的仪器合理的是
A.用100 mL的量筒量取5.2 mL盐酸
B.用25 mL的碱式滴定管量取14.80 mL的NaOH溶液
C.用托盘天平称取25.20 g氯化钠
D.用100 mL容量瓶配制50 mL 0.1 mol/L的H2SO4溶液
4.近年来,我国电力供求持续紧张,尤以2004年最为严重。中国科学院经过对国内能源储备和应用的调研分析后认为:太阳能是最经济实惠、最适合中国国情的新能源,是中国乃至世界面临能源危机的最佳解决方案。太阳能的应用在发达国家已经发展得比较成熟了,我国应该大力推行太阳能在日常生活中的使用,以便节约电力,满足正常的生产、生活需求。譬如,室内可利用储能介质储存太阳能,其原理是:白天在太阳光照射下某种固体盐熔化(实为盐溶于自身的结晶水)吸收能量,晚间熔盐释放出相应能量,从而使室温得以调节。已知几种盐的熔点及熔化时能量改变值如下表所示:
|
盐 |
熔点/℃ |
质量(g)与相对分子质量数值相等的盐熔化时吸热/kJ |
|
CaCl2·6H2O |
29.0 |
37.3 |
|
Na2SO4·10H2O |
32.4 |
87.0 |
|
Na2HPO4·12H2O |
36.1 |
100.1 |
|
Na2S2O3·5H2O |
48.5 |
49.7 |
下列有关说法正确的是( )
①不宜选用CaCl2·6H2O ②可选用Na2SO4·10H2O和Na2HPO4·12H2O ③最好选用Na2S2O3·5H2O ④最好选用Na2SO4·10H2O
A.①② B.②③ C.①③ D.②④
3.在25 OC,1.01×105Pa条件下,反应2N2O5(g)==4NO2(g)+O2(g) △H=+56.7kJ/mol能自发进行的合理解释是
A.该反应是熵减反应 B.该反应是分解反应
C.该反应的焓变效应大于熵变效应 D.该反应的熵变效应大于焓变效应
2.某温度下在2L密闭容器中,反应2SO2+O2 ≒2SO3进行一段时间后SO3的物质的量增加了0.4 mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·s-1,则这段时间为( ) A.0.1s B.0.25s C.0.5s D.2.5s
1.纯水在80℃时的pH
A.等于7 B.大于7 C.小于7 D.无法确定
30. (9分)500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假设电解前后溶液的体积不变,求(1)原混合溶液中 c (K+)是多少?(2)电解后溶液中c(H+)是多少?
29.(10分)如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
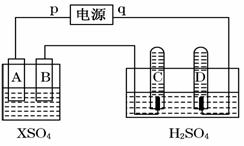
(1)p为____ ____极
(2) C极的电极方程式是____________________________________________
(3).在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
阴极生成气体 体积(cm3) |
6 |
12 |
20 |
29 |
39 |
49 |
59 |
69 |
79 |
89 |
|
阳极生成气体 |
2 |
4 |
7 |
11 |
16 |
21 |
26 |
31 |
36 |
41 |
|
体积(cm3) |
仔细分析以上实验数据,请说出可能的原因是_____________________________
____________________________________________________________________.
(4)当反应进行一段时间后,A、B电极附近溶液的pH________(填“增大”“减小”或“不变”).
(5)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为____ ____.
28.(8分)下列框图中的物质均为中学化学常见物质,其中A、B、C、D、F、H为单质,常温常压下A、C、D为气体,B、F、H为金属,且F、H为生活中常见金属,其余为化合物。
请回答下列问题:
(1)J的电子式为 ,生成1 mol I转移 mol电子。
(2)写出下列反应的化学方程式:
丙―→D+H: 。
(3)J+乙―→D+K,当把K的溶液滴入G的溶液中时,产生的现象为 。
27. (8分) Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =4LiCl+S +SO2。
(8分) Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =4LiCl+S +SO2。
请回答下列问题:
(1)电池的负极材料为
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,反应的化学方程式为 ;
(4)组装该电池能不能在有水、有氧的条件下进行 。(填能或不能)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com