
题目列表(包括答案和解析)
21、(1)① ; ;
② ; ;
(2)① ; ② ;
20、(1) ; ;
(2) ; ;
(3) ;
19、(1) ;
(2)① ; ② 和 ;
③ ;
18、(1) ;
(2)① ; ;② ;
17、(1)① ;② ;③ ;
(2)① ;② ;③ ;④ ;
|
题目 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
答案 |
|
|
|
|
|
|
|
|
|
题目 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
答案 |
|
|
|
|
|
|
|
|
22、把N2和H2以1:1的物质的量比混合后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空容器中(四个容器的容积固定,且不等),在保持相同温度的条件下,四容器中的合成氨反应相继达到平衡状态。分析表中的实验数据后回答有关问题(用A、B、C、D填空)。
|
容器代码 |
A |
B |
C |
D |
平衡时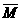 (混) (混) |
|
|
16 |
17 |
|
平衡时N2转化率 |
20% |
|
|
|
|
平衡时H2转化率 |
|
30% |
|
|
(1)都达到平衡时, 容器的NH3的物质的量所占的比例最大。
(2)四个容器的容积由小到大的顺序是 。
|
21、t℃时,将3 mol A和4 mol B气体通入容积为2L的密闭容器中,发生反应:2A(g)+xB(g) 3C(g),2 min时反应达到平衡状态,剩余1 mol A,并测得B的浓度为1 mol/L。
3C(g),2 min时反应达到平衡状态,剩余1 mol A,并测得B的浓度为1 mol/L。
(1)若该密闭容器容积不变,请回答下列问题:
①x= ;用C表示该反应的速率为 。
②在t℃时,若起始时,只充入4.5 mol C气体,欲使达到平衡时,各物质的物质的量分数与原平衡相同,则起始n(A)= mol,n(B)= mol。
(2)假设化学方程式与(1)中相同,若该密闭容器的容积可变,t℃时,将3 mol A和4 mol B气体充入该密闭容器中,一段时间后可达到平衡状态,请回答下列问题:
①继续向平衡混合物的容器中通入少量Ne后,保持压强不变,下列说法错误的是 。
A.密闭容器体积增大,容器内压强不变 B.v正、v逆同等改变,平衡不移动
C.化学平衡正向移动 D.达到新平衡后,A气体的转化率降低
②t℃时,若A、B、C起始时物质的量分别为a mol、b mol、c mol,无论反应是从正反应开始,还是逆反应开始,若要建立与(2)相同的平衡状态,a、b、c应满足的条件是 。(只需列出关系式,不需化简)
20、已知某浓度的硫酸在水中的电离方程式:H2SO4===H++HSO4-,HSO4- H++SO42-。
H++SO42-。
(1)Na2SO4溶液显 (填“酸性”、“碱性”或“中性”),理由是
(用离子方程式表式)。
(2)在25℃时0.1 mol·L-1的NaHSO4溶液中c(SO42-) =0.029 mol·L-1,则25℃时,0.1 mol·L-1 H2SO4溶液中c(SO42-) (填“大于”、“小于”或“等于”)0.029 mol·L-1,理由是 。
(3)在0.1 mol·L-1Na2SO4溶液中,下列粒子浓度关系正确的是( )。
A.c(Na+) +c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
B.2 c(Na+)=c(SO42-) +c(HSO4-)
C.c(Na+)>c(SO42-)>c(H+)>c(OH-)
D.c(SO42-)+c(HSO4-)=0.1 mol·L-1
19、(1)用物质的量都是0.1 mol的CH3COOH和CH3COONa在常温下配成1 L混合溶液,已知其中的c(CH3COO-)>c(Na+),则对该混合溶液的下列判断中正确的是 。
①c(H+)>c(OH-) ②c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1
③c(CH3COO-)<c(CH3COOH) ④c(CH3COOH)+c(H+) =0.1 mol·L-1
A.只有② B.①和② C.①②③ D.全部正确
(2)常温下,将0.01 mol CH3COONa和0.004 mol HCl溶于水,配制成0.50 L混合液,判断:
①溶液中共有 种微粒;
②溶液中有两种微粒的物质的量之和一定等于0.010 mol,它们是 和 。
③溶液中n (CH3COO-)+n(OH-)-n(H+)= mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com