
题目列表(包括答案和解析)
3.在蒸发皿中蒸干灼烧下列物质的浓溶液,可以得到该物质固体的是( )
A.溴化铁 B.硫酸铝钾 C.亚硫酸钠 D.磷酸铵
2.0.2mol/L的Ba(OH)2溶液和0.15mol/L的NaHCO3溶液等体积混合,则最终所得的溶液中各离子的浓度由大到小的顺序是( )
A.C(CO32-)<C(Ba2+)<C(Na+)<C(OH-) B.C(CO32-)< C(Na+)<C(Ba2+)<C(OH-)
C.C(CO32-)<C(Ba2+)<C(OH-)< C(Na+) D.C(CO32-)< C(Na+)<C(OH-)<C(Ba2+)
1.1mol/L的醋酸钡溶液中粒子浓度的比较不正确的是( )
A.2C(Ba2+)=C(CH3COO-)+C(CH3COOH) B.C(OH-)- C(CH3COOH) = C(H+)
C.C(CH3COO-) + C(OH-) = C(H+)+2C(Ba2+) D.C(Ba2+)> C(CH3COO-)> C(OH-)> C(H+)
27.常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液与pH=3的某一元弱酸(HA)溶液20ml反应,消耗了NaOH溶液13ml,试求:(要求写出计算过程)(1)NaOH溶液的物质的量浓度。
(2)此一元弱酸的物质的量浓度。 (3)求此条件下该一元弱酸的电离平衡常数。
26.(16分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
 (1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是
由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
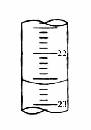
(5)右图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
25.00 |
0.50 |
20.40 |
|
第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度: mol/L
25.(10分)25℃时,有下列四种溶液:
①0.1mol/L CH3COOH溶液 ②pH=13 NaOH溶液
③ 0.05mol/L H2SO4 ④0.1mol/L Na2CO3溶液
请根据要求填写下列空白:
(1)溶液④呈 (填“酸性”、“碱性”或“中性”),
请写出①④ 反应的离子方程式
(2)在上述①至④四种溶液中,pH由大到小的顺序为 ﹝填序号﹞
(3)将该温度下a mL的溶液②与b mL的溶液③混合,所得混合溶液的pH=7,
则a:b =
(4)若使①溶液的c(CH3COO-)提高,在如下措施中可采取(填标号)
A.加盐酸 B.加浓醋酸 C.加入固体KOH D.加Zn粒 E.加固体CH3COONa
24.(共6分)在某温度下,测得0.01 mo1/L NaOH溶液的pH为10。
⑴该温度下,水的离子积常数Kw=
⑵该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合
①若所得混合液为中性,且a=12,b=2,则Va:Vb=
②若所得混合液为中性,且Va:Vb=1:1,则a+ b =
23.(共14分)(1)现有①硫酸铜②石灰石③磷酸④硫化氢⑤三氧化硫⑥金属镁⑦石墨⑧苛性钾⑨氨水⑩熟石灰,其中(填序号)属于强电解质的是 ,属于弱电解质的是 ,属于非电解质的是 ,既不是电解质,又不是非电解质的是 。
(2)用pH试纸测定氨水的pH,正确操作是 。
(3)用电离方程式表示氨水中存在的电离:
22.已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液中c(H+)=10-4 mo1/L B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
21.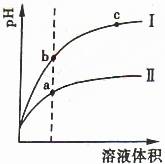 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的 ( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的 ( )
A.Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Ka的数值比c点Ka的数值大
D.b点酸的总浓度大于a点酸的总浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com