
题目列表(包括答案和解析)
20.(10分) 高炉炼铁过程中发生的主要反应为

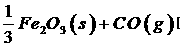

已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率v(C02)= _____________、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe203的量 C.移出部分C02
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
19.(6分)
某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
(1) 溶液中的H+物质的量取值范围是:
(2) 已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”,“>”,或“=”),理由是: 。
18.(6分)
(1) NaHCO3的水溶液呈 (填“酸”、“中”、“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用 塞,原因
(写出有关的离子方程式,下同);Al2(SO4)3显酸性,溶液蒸干最后得到的固体产物是 ;
(2) 普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是
。
17.(12分)
(1) 有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是 。
(2) 向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
(3) 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是_______________
①20 mL 0.01 mol·L-1KCl溶液 ②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液 ④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
(4) 某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。此电池的负极发生的电极反应式是______________________ ;
16.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
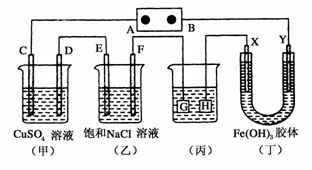
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中X极附近红褐色不变
第II卷 主观卷(共52分)
15. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为,
|
|
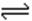 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH下列叙述不正确的是
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH下列叙述不正确的是
A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
B.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
C.充电时阳极反应为:Fe(OH)3 -3e- + 5 OH- = FeO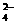 + 4H2O
+ 4H2O
D.放电时正极附近溶液的碱性增强
14.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol CuO后恰好恢复到电解前的浓度。则电解过程中转移的电子数为
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
13. 已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI> Ag2CrO4
B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
12. 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3 主要:Cu2+ + CO32-+ H2O = Cu(OH)2↓+ CO2↑
次要:Cu2+ + CO32- = CuCO3↓
(2) CuSO4 +Na2S 主要:Cu2+ + S2- = CuS↓
次要:Cu2+ + S2-+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
A. CuS<Cu(OH)2<CuCO3
B. CuS>Cu(OH)2>CuCO3
C. Cu(OH)2>CuCO3>CuS
D. Cu(OH)2<CuCO3<CuS
11.现有 0.4mol/L HA溶液和 0.2mol/L NaOH溶液等体积混合组成溶液。下列有关推断正确的是
A.若该溶液中HA电离能力大于A-水解能力,则有
c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B. 若该溶液中HA电离能力小于A-水解能力,则有
c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
C. 无论该溶液呈酸性还是碱性,都有
c(A-)+ c(OH-)=c(Na+)+c(H+)
D. 无论该溶液呈酸性还是碱性,
c(Na+)=c(A-)+c(HA)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com