
题目列表(包括答案和解析)
21、(10分)硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度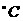 |
450 |
500 |
550 |
600 |
|
SO2的转化率% |
97.5 |
95.8 |
90.50 |
80.0 |
(1)由表中数据判断△H 0(填“>”、“=”或“<”)
(2)能判断该反应是否达到平衡状态的是
A. 容器的压强不变 B. 混合气体的密度不变
C. 混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F. V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1.
①0~2min之间,O2的反应速率为 .
②此时的温度为 ℃.
③此温度下的平衡常数为 (可用分数表示).

 (4)若将平衡反应混合物的压强增大(假如体积可变),平衡将
向移动.
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将
向移动.
20.(16分)下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I、属于非电解质的是 ;(填序号)
Ⅱ、⑴NaHCO3是一种 (填“强”或“弱”)电解质;
⑵写出HCO3―水解的离子方程式: ;
⑶常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH― 五种微粒的浓度由大到小的顺序为: 。
⑷常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知:10-5.60=2.5×10-6)
Ⅲ 、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
⑴该Ba(OH)2溶液的物质的量浓度为___________________;
⑵溶液中由水电离出c(OH―)=______________;
⑶与某浓度盐酸溶液按体积比(碱与酸之比)1: 9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
Ⅳ、醋酸是一种弱电解质。
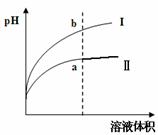
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,
平衡pH值随溶液体积变化的曲线如右图所示。则图
(填“I”或“Ⅱ”)为醋酸稀释的图像。
19.(16分)CH4 是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ·mol-1 。它可以作为燃料电池的燃料。
⑴写出甲烷燃烧的热化学方程式: ;
⑵已知H2(g)和C(S)的燃烧热分别是285.8KJ·mol-1、393.5KJ·mol-1;则反应C(S)+ 2H2(g)= CH4(g)的反应热⊿H= ;
⑶以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为: ;
⑷用⑶中的燃料电池为电源,以石墨为电极电解500ml滴有酚酞的NaCl溶液,装置如图所示:
①请写出电解过程中阴极附近观察到的现象: 。
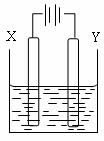 ②到燃料电池消耗2.8L O2(标准状况下)时,计算此时NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。在Y极通过的电子的物质的量为: 。
②到燃料电池消耗2.8L O2(标准状况下)时,计算此时NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。在Y极通过的电子的物质的量为: 。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质 (填名称)。
溶液中Cl―流向 极(填“X”或“Y”)。
18、(7分)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
⑴盛装0.2000 mol/L盐酸标准液应该用 式滴定管。
⑵滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______________________________为止。
⑶ 滴定操作可分解为如下几步:
①检查滴定管是否漏水; ②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器 ⑥滴定操作
正确的操作顺序为: 。
⑷有关数据记录如下:
|
实验序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
26.00 |
|
3 |
20.00 |
1.40 |
21.20 |
则NaOH溶液的物质的量浓度为______________mol/L。
⑸若只用蒸馏水冲洗锥形瓶,则测定结果_________________;若滴定前平视读数,滴定终点时俯视读数,则会使所测酸的浓度值 。(填“无影响”、“偏高”或“偏低”)。
17、有关AgCl的溶解沉淀平衡的说法中,不正确的是()
A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl―
C.升高温度时,AgCl的溶解度增大
D.向AgCl饱和溶液中,加入NaCl固体,会析出AgCl固体
第Ⅱ卷(非选择题,共49分)
16、用pH试纸测定溶液pH的正确操作是: ( )
A.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
15、 对于可逆反应A(g)+2B(g)
对于可逆反应A(g)+2B(g)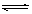 2C(g) △H>0,下列图象中正确的是( )
2C(g) △H>0,下列图象中正确的是( )
14、已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。则该温度下,下列说法正确的是( )
A.在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
B.饱和Mg(OH)2溶液与饱和MgF2 溶液相比,前者的c(Mg2+)大
C.Mg(OH)2固体在20ml0.01 mol·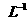 氨水中的Ksp比在20mL 0.01mol·
氨水中的Ksp比在20mL 0.01mol·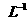 NH4Cl 溶液中的Ksp小
NH4Cl 溶液中的Ksp小
D.在Mg(OH)2的悬浊液加入NaF 溶液后,Mg(OH)2不可能转化成为MgF2
13、常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确是( )
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)
12、已知水的电离方程式:H2O
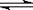 H+
+ OH-。下列叙述中,正确的是 ( )
H+
+ OH-。下列叙述中,正确的是 ( )
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com