
题目列表(包括答案和解析)
20.25℃时,现有HX、HY、HZ三种酸
A.HZ>HX>HY B.HZ>HY>HX C.HY>HX>HZ D.HX > HZ >HY
19.设NA为阿伏加德罗常数,下列说法正确的是( )
A.1L 0.1mol/L的Na2CO3溶液中,含Na+ 0.2 NA个,CO32- 0.1 NA个
B.1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C.2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D.0.1mol/L的H3PO4溶液中,c(H+)∶c(PO43-)<3∶1
|
|
HX |
HY |
HZ |
|
浓度mol/L |
1 |
0.1 |
0.1 |
|
电离度% |
0.3 |
0.3 |
10 |
18.25 ℃时,水的电离达到平衡:H2O 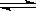 H+ + OH- ΔH > 0 ,下列叙述正确的是(
)
H+ + OH- ΔH > 0 ,下列叙述正确的是(
)
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D.将水加热,Kw增大,pH不变
17.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.电离程度
C.H+的物质的量浓度 D.CH3COOH的物质的量
16.在同体积同浓度的①稀H2SO4、②稀HCl、③稀HNO3、④稀CH3COOH溶液中,分别加入足量的Zn,放出氢气量从多到少的正确排序是( )
A.①>②=③>④ B.①>②=④>③ C.①>③=②>④ D.①>④=③>②
15.将K2SO4、Al2(SO4)3、KAl(SO4)2三种盐混合溶于硫酸酸化的水中配成稀溶液,测得c(SO42-)=0.105 mol·L-1、c(Al3+)=0.055mol·L-1,c (H+)=0.01 mol·L-1,则c(K+)为( )
A.0.045mol·L-1 B.0.055mol·L-1 C.0.035mol·L-1 D.0.040mol·L-1
14.某化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。
HIn(溶液)
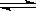 H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的各溶液①盐酸②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水其中能使指示剂显红色的是( )
A.①④ B.⑤⑥ C.①② D.②③
13.25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是( )
A.该溶液的pH一定是9 B.该溶液pH一定为5
C.该溶液的pH可能是9或5 D.不会有这样的溶液
12.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
A.向水中投入一小块金属钠 B.将水加热煮沸
C.向水中通入二氧化碳气体 D.向水中加食盐晶体
11.20℃时H2S饱和溶液1L,其浓度为0.1mol·L-1,其电离方程式为H2S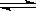 H++HS-,HS-
H++HS-,HS-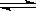 H++S2-,若要使该溶液c(S2-)增加,可采取的措施是( )
H++S2-,若要使该溶液c(S2-)增加,可采取的措施是( )
A.加入适量的水 B.通入适量硫化氢
C.通入适量氯化氢 D.加入适量的NaOH固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com