
题目列表(包括答案和解析)
21.(8分)水的电离平衡曲线如下图所示:
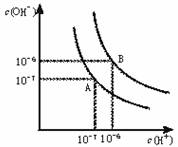
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
20.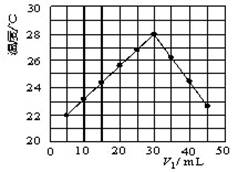 (12分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2
mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(12分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2
mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度_______(填“高于”、“低于”或“等于”)22 ℃,判断的依据是 。
(2)由题干及图形可知,V1/V2= : 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学方程式:______________________________________。
19.(10分)常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)该溶液中存在的三个平衡体系是__________________、__________________、______________________。(用方程式表示)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。(各填写一种粒子)
(4)物质的量之和为0.01mol的两种粒子是____________________。
(5) 和 两种粒子数量之和比OH-多0.008mol
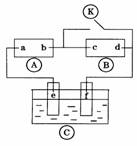
18.下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
化学试卷第II卷(共46分)
17.下列描述中,不符合生产实际的是
A.电解熔融的氯化钠制取金属钠,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
 D.在镀件上电镀锌,用锌作阳极
D.在镀件上电镀锌,用锌作阳极
16.PH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
15.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.滴定过程中振荡过猛,有溶液溅出
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
14.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目
13.已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1。现用0.1mol/L的盐酸滴定10mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是
A.10mL B.5mL C.大于5mL D.小于5mL
12.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com