
题目列表(包括答案和解析)
1.下列关于保健食品的说法正确的是( )
A. 保健食品对人体健康有益,人人都应服用保健食品
B.保健食品对人体具有特定的保健功能,可以代替药物的治疗作用
C. 保健食品的包装上印有蓝色标志,标志下面注明批准生产的日期和文件号
D. 所有的保健食品都有调节免疫、延缓衰老、改善记忆等功能
24.
(1) 66.5
(2) 要点之一:D中所含的另一种元素的总式量为:66.5×(1-0.4211-0.5338)=3,元素的相对原子质量比3小的唯有H元素,故D分子中必有3个氢原子。
要点之二:据要点之一,推定E为氢化物,设其分子式为XHn ,X的相对原子质量为a,则:
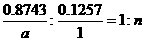 ,a=7n,经讨论,当n=4,a=28时符合题意。因此X为Si
,a=7n,经讨论,当n=4,a=28时符合题意。因此X为Si
要点之三:据要点一与要点二可立即假设D为SiH3Y。 要点之四:设Y的相对原子质量为b,据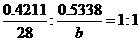 得b=35.5,故Y是Cl
得b=35.5,故Y是Cl
要点之五:由F中X、Y的质量分数,可求得其最简式为SiCl3,从价态不难得出F的分子式为Si2Cl6
因此各物质分别为:A.SiCl4; B.SiHCl3; C.SiH2Cl2; D.SiH3Cl; E.SiH4; F.Si2Cl6
24.下列六种化合物(A-F)中含有的元素不多于三种,且分子内所含X、Y元素的质量分数及化合物的部分性质列于下表。
|
化合物 |
A |
B |
C |
D |
E |
F |
|
ω(x) |
0.1653 |
0.2069 |
0.2781 |
0.4211 |
0.8743 |
0.2089 |
|
ω(y) |
0.8347 |
0.7852 |
0.7019 |
0.5338 |
0 |
0.7911 |
|
常压下t℃的密度g/cm3 |
1.448 (20℃) |
1.145 (-113℃) |
1.42 (-122℃) |
2.973×10-3 (0℃) |
0.68 (-168℃) |
- |
|
沸点/℃ |
57 |
30.4 |
8.3 |
-12 |
-111.8 |
145 |
|
熔点/℃ |
-70.4 |
-118 |
-122 |
-130 |
-185 |
3 |
|
分子极性 |
非极性 |
极性 |
极性 |
极性 |
非极性 |
- |
根据上表有关信息回答下列问题:
⑴计算化合物D的相对分子质量。
⑵确定六种化合物的化学式,写出推理和计算过程。
23.为测定一种复合氧化物型的磁性粉末材料的组成,称取12.52g样品,将其全部溶于过量稀硝酸后,配成100mL溶液。取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66g固体。在余下的50mL溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得到3.20g固体。
(1)计算磁性粉末材料中氧元素的质量分数。
(2)确定材料的化学式。
(1) 钡的质量为5.48 g,铁4.48 g,氧为20.45%
(2) 原子个数比为Ba∶Fe∶O=1∶2∶4,化学式为BaFe2O4(BaO·Fe2O3)
22.由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1)微粒A的化学式是_____________;微粒E的名称是___________________。构成微粒F的元素在元素周期表中的位置是_________________________________。
(2)写出F与过量C溶液反应的离子方程式:___________________ ______
(3)六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加人浓苛性钠溶液,产生的现象有:a.溶液中出现白色沉淀b.有刺激性气味气体放出c.沉淀逐渐增多d.沉淀完全消失e.沉淀逐渐减少
该复盐在溶液中的电离方程式是__________ __ _____________。
(1) NH4+水合氢离子 第三周期、ⅢA族
(2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al(OH)3+OH-=AlO2-+2H2O
(3)①NH4Al(SO4)2=NH4++Al3++2SO42-
21.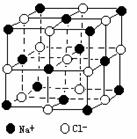 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶 胞。NaCl晶体结构如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶 胞。NaCl晶体结构如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管_____ _,其原因是 ____________。
⑶能否用水代替苯______ _,其原因是_________ __________ ______________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为a cm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________ 。
⑸纳米材料的表面原子占原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为_________________。
容量瓶 否 不能测出滴加苯的体积 否 氯化钠会溶于水
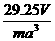
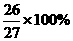
20.(1)用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
(2)果糖分子的结构简式为CH2OH(CHOH)3COCH2OH,试写出其结构式。并用*标记出其中的手性碳原子。
答:(1)B原子的2s轨道上的一个电子受激发跃迁到2p轨道上,在F原子的作用下发生了sp2杂化。与三个F原子形成三个σ键。故是平面三角形。而在NF3分子中N原子发生了sp3杂化形成四个sp3杂化轨道,其中有一对孤对电子占据一个轨道。另三个轨道与三个F形成三个σ键,故是三角锥形。
(2)
H H H H H
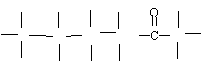
 H C C* C* C* C H
H C C* C* C* C H
OH OH OH OH OH
19. 一种离子晶体的晶胞如右图其中阳离子A以
一种离子晶体的晶胞如右图其中阳离子A以 表示阴离子B以
表示阴离子B以 表示。
表示。
(1)每个晶胞种含A离子的数目为________,含B离子数目为________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离
子化合物的化学式是___________________;
(3)阳离子周围距离最近的阴离子数为_____,阴离子周围距离最近的阳离子数_____。
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。
19 (1)4、8 (2)CaF2 (3)8、4 (4)16r3
18.(1)
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
Na |
|
|
|
|
|
Cl |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)IVA (3)①右表中 ②氯 H2S+Cl2→2HCl+S↓
18.
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可反氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
②甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式 。
(4)画出a元素原子的电子排布式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com