
题目列表(包括答案和解析)
24.(12分)把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量,原因是
。
(2)△H1、△H2、△H3、△H4的数学关系式是 。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为 。
(4)煤炭作为燃料采用途径II的优点有
。
23. (8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
 A.热裂解形成燃油 B.露天焚烧
A.热裂解形成燃油 B.露天焚烧
 C.作为有机复合建筑材料的原料 D.直接填埋
C.作为有机复合建筑材料的原料 D.直接填埋
 (2)用
(2)用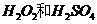 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

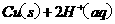 ====
====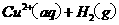
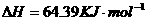

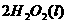 ====
====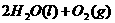
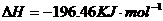

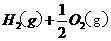 ====
==== 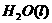
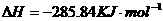
 在
在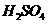 溶液中
溶液中 与
与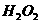 反应生成
反应生成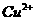 和
和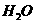 的热化学方程式为
的热化学方程式为
。
 (3)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
(3)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
22. (12分)2SO2(g)+O2(g)
=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=
-99kJ·mol-1。请回答下列问题:
(12分)2SO2(g)+O2(g)
=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=
-99kJ·mol-1。请回答下列问题:
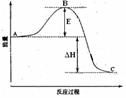
 (1)图中A、C分别表示
、
,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 ____________(填“升高”还是“降低”),△H
(填“变大”、“变小”或“不变”),理由是
(1)图中A、C分别表示
、
,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 ____________(填“升高”还是“降低”),△H
(填“变大”、“变小”或“不变”),理由是
 (2)图中△H=
KJ·mol-1;
(2)图中△H=
KJ·mol-1;
 (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式
、 。
 (4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3
molSO3(g)的△H(要求计算过程)。
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3
molSO3(g)的△H(要求计算过程)。
21.(8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
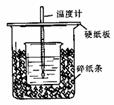
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
20.已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是 ( )
A.1︰1 B.1︰2 C.2︰3 D.3︰2
19.完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是
( )
A.0.2Q B.0.1Q C.5Q D.10Q
18.相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是 ( )
A.Q1=Q2<Q3 B.Q2 > Q1 >Q3 C.Q3> Q2> Q1 D.Q1=Q2=Q3
17.已知热化学方程式:
H2O(g)=H2(g) + O2(g) △H = +241.8kJ/mol
H2(g)+ O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是 ( )
A.吸热88kJ B.吸热2.44KJ C.放热44kJ D.吸热44KJ
16.已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ,下列说法正确的是 ( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
15.在36 g 碳不完全燃烧所得气体中,CO占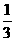 体积,CO2占
体积,CO2占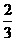 体积,且
体积,且
C(s) + O2(g) = CO(g) △H = -110.5 kJ/mol
CO(g) + O2(g) = CO2(g) △H = -283 kJ/mol
与这些碳完全燃烧相比,损失的热量是 ( )
A.172.5 kJ B.1149 kJ C.283kJ D.517.5 kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com