
题目列表(包括答案和解析)
22、(2分)
第Ⅱ卷(共6题,40分)
21、(4分)
26、(10分)写出下列反应的化学方程式
(1)、小苏打与氢氧化钠溶液反应
(2)、工业制取漂白粉
(3)、氯碱工业
(4)、铜与浓硫酸反应
(5)、铁与水蒸汽在高温条件下反应
(6)、焊接钢轨的原理
(7)、金属镁在CO2气体中燃烧
(8)、往偏铝酸钠溶液中通入足量CO2气体
(9)、SiO2与碳在高温条件反应
(10)、金属铝与氢氧化钠溶液反应
第Ⅰ卷
25、(11分)钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式为:
____________________________________________ 。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的化学方程式______________________________ 。
(3)下列哪个装置可防止铁棒被腐蚀_____________ 。
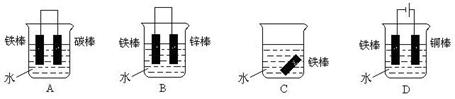
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
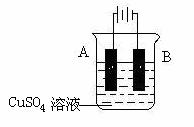
请回答:
① A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为__________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
24、(8分)在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:

(1)写出该反应的平衡常数表达式:K=___________________。
已知:K(300℃)>K(350℃),该反应是________热反应。
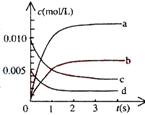
(2)右图中表示NO2的变化的曲线是____________。
用O2表示从0-2s内该反应的平均速率v=___________。
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的物质的量 d、选择高效的催化剂
23、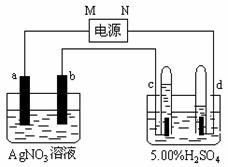 (5分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。请回答下列问题。
(5分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。请回答下列问题。
(1)直流电源中,N为 极。
(2)AgNO3溶液的浓度___________(填增大、减小或不变。)H2SO4溶液的pH _____。(填增大、减小或不变。)
(3)Pt电极上生成的物质是 ,其质量为 g。
22、(2分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
21、(4分)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应
3A(g)+B(g) xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L
xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L
c(A):c(B)=3:5,C的反应速率是0.125 mol·L-1·min-1,A在4 min末的浓度是__________, x的值是__________。
20、X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z
,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
2Z
,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
第Ⅱ卷(共6题,40分)
19. 下表中是各组反应的反应物和反应温度,反应刚开始时,放出H2速率最快的是
|
编号 金属(粉末状) 酸的浓度及体积
反应温度 (mol) (℃) |
|
A Mg,0.1 6 mol·L-1 硝酸10mL
60 B Mg,0.1 3 mol·L-1 盐酸10mL 60 C Fe,0.1 3 mol·L-1L 盐酸10mL 60 D Mg,0.1 3 mol·L-1 硫酸10mL 60 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com