
题目列表(包括答案和解析)
22.(7分)
某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x的值。通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O。该组同学利用该反应原理设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
|
滴定次数 |
待测草酸溶液体积(mL) |
0.1000 mol/LKMnO4标准溶液体积(mL) |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
第一次 |
25.00 |
0.00 |
10.02 |
|
第二次 |
25.00 |
0.22 |
11.32 |
|
第三次 |
25.00 |
1.56 |
11.54 |
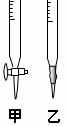 请回答:
请回答:
(1)滴定时,将KMnO4标准液装在右图中的 (填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志可以是 。
(3)通过上述数据,计算出x= 。
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
21.(11分)
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
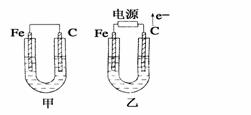
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______________________________。
②甲池中石墨电极上的电极反应属于______(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,反应的化学方程式为__________________________________。
④若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=_______。
20.(8分)
目前工业上有一种方法是用CO2来生产燃料甲醇。
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
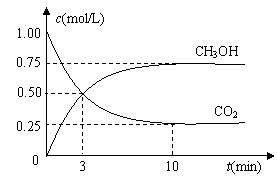 在体积为1 L的密闭容器中,充入1mol CO2和4 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
在体积为1 L的密闭容器中,充入1mol CO2和4 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。
(2)该反应的平衡常数表达式为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1 mol CO2和4 mol H2

19.(8分)
能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH= kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
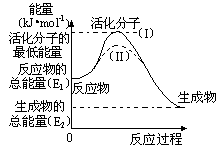 ① 图中反应的ΔH=
kJ/mol(用含有E1、E2代数式表示)。
① 图中反应的ΔH=
kJ/mol(用含有E1、E2代数式表示)。
② 已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为 kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
。
18.(10分)
有A、B、C、D、W五种元素。W的原子序数为29,其余的均为短周期主族元素;其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个未成对的电子;C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐;D原子核内的质子数与中子数相等,能与B形成DB2、DB3常见化合物。根据以上条件,回答下列问题:
(1)推断元素名称:A 。
(2)C元素的氢化物的空间构型为 ,分子中的化学键 (填“有”或“无”)极性,其分子为 分子(填“极性”或“非极性”)。
(3)比较A、B、C三种元素的第一电离能由大到小的顺序 (用元素符号表示),A、B、C三种元素的氢化物的沸点高低 (用化学式表示)。
(4)写出D元素原子基态时的电子排布式 ,其在元素周期表中的位置 。
(5)W元素+2价离子的水溶液呈现天蓝色,是该离子与水分子通过 键形成的 (填化学式)而显示出的颜色。
17.(8分)
现对0.1 mol/L的纯碱溶液进行相关研究。
(1)用pH试纸测定该溶液的pH,其正确的操作 。
(2)由上测得纯碱溶液呈碱性,请用离子方程式表示其原因: 。
(3)某同学根据所学知识对溶液进行分析,写出了以下四个关系式。请你判断:在正确的关系式后面打“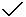 ”,在错误的后面写出正确的关系式。
”,在错误的后面写出正确的关系式。
① c()= 2[c(2-3 )+c(HCO-3 ) ]: ;
② c()+c(H+)= 2 c(2-3 )+c(HCO-3 )+c(OH-): ;
③ c(OH-)= c(H+)+c(HCO-3 ) +c(): ;
④ c()>c(2-3 )>c(OH-)>c(HCO-3 ) : 。
16.已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10。在该温度下,向50 mL 0.018 mol/L的AgNO3溶液中加入50 mL 0.02 mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计)。下列说法正确的是
A.沉淀生成后,溶液中NO3-的浓度1.8×10-2 mol/L
B.沉淀生成后,溶液的pH为2
C.沉淀生成后,溶液中Ag+的浓度1×10-5 mol/L
D. AgCl的溶解性为难溶,则该物质不溶于水
第Ⅱ卷 非选择题(共52分)
15.下列各组原子中,彼此化学性质一定相似的是
A.最外层都只有一个电子的X、Y原子
B.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子
C.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
D.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
14.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节能诱发关节疼痛,其化学机理为:①HUr(尿酸)+H2O Ur- (尿酸根离子)+H3O+;②Ur- (aq)+Na+ (aq)
Ur- (尿酸根离子)+H3O+;②Ur- (aq)+Na+ (aq)  NaUr(s)。下列对反应②的叙述中正确的是
NaUr(s)。下列对反应②的叙述中正确的是
A.反应的ΔH>0 B.升高温度,平衡向正反应方向移动
C.反应的ΔH<0 D.降低温度,平衡向逆反应方向移动
13.下列有关说法错误的是
A.P、S、Cl元素的最高化合价依次升高
B.H2O、NH3、CH4分子的中心原子均为SP3杂化轨道类型
C.Na、K、Rb第一电离能逐渐增大
D.N、O、F电负性依次增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com