
题目列表(包括答案和解析)
1.图中甲池是____________________ (填“原电池” “电解池”)。
20.(10分)下图是一个电化学过程的示意图。
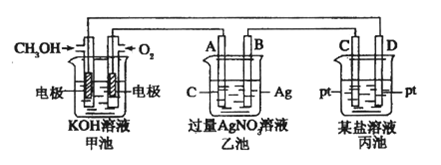
请回答下列问题:
19.(8分)(I)化学是一门以实验为基础的学科,下列实验操作的描述中,正确的是________________(填序号)。
① 为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
② 酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
③ 配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥
④ 以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液,待溶液变成浅红色时即停止滴定
⑤ 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
⑥滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整
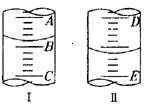 (II)填空
(II)填空
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是______。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) 。
A.是amL B.是(50-a)mL C.-定大于amL D.一定大于(50-a)mL
18.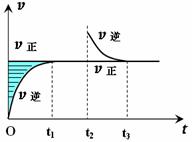 某恒温密闭容器发生可逆反应Z(?)+W(?)
某恒温密闭容器发生可逆反应Z(?)+W(?) X(g)+Y(?) ΔH>0 ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
X(g)+Y(?) ΔH>0 ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
A.Z和W在该条件下一定不为气态
B.t1-t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=C(X),则t1-t2时间段与t3时刻后的X浓度相等
D.该反应的平衡常数K随温度升高而增大
第Ⅱ卷
17..已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11 。下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2
16.一定温度下,lmol X和n mol Y在体积为2L的密闭容器中发生如下反应:
X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
A.用X表示此反应的反应速率是(0.1-0.2a)mol·(L·min)-1
B.向平衡后的体系中加入lmol M,平衡向逆反应方向移动
C.当混合气体的质量不再发生变化时,说明反应达到平衡状态
D.向上述平衡体系中再充入lmol X,v(正)增大,v(逆)减小,平衡正向移动
14. 镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2= Mg2++2H2O。关于该电池说法正确的是
A.放电时H+在正极反应得电子
B.正极方程式为:H2O2+2e-=2OH-
C.镁合金为电源负极,发生氧化反应
D.放电时正极的pH降低
15 今有室温下四种溶液,有关叙述不正确的是
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.分别加水稀释10倍,四种溶液的pH ①>②>④>③
B.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va ∶Vb= 11∶9
13.下列叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1molBa(OH)2的稀溶液和含1molH2SO4的稀溶液反应释放热量aKJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l);△H=-aKJ/mol
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
12.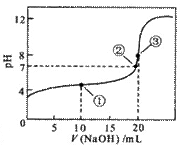 常温下,用0.1mol/L NaOH溶液滴定
20.00mL 0.1 mol/L CH3COOH溶液滴定曲线如右图。下列说法正确的是
常温下,用0.1mol/L NaOH溶液滴定
20.00mL 0.1 mol/L CH3COOH溶液滴定曲线如右图。下列说法正确的是
A. 点①所示溶液中:
c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:
c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:
c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:
c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
11.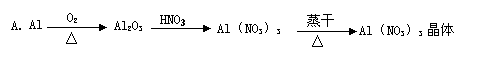 下列各步制取物质,最终无法达到目的的有
下列各步制取物质,最终无法达到目的的有
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com