
题目列表(包括答案和解析)
6. 在标准状况下,1mol任何气体的体积都约是22.4L。
5. 计算关系:
n= / m= M=
4. 摩尔质量:1mol任何物质的质量,称为该物质的摩尔质量。用符号 表示,常用单位为 ,在数值上等于该物质的相对原子质量或相对分子质量
3. 1 mol粒子的数目是 中所含的碳原子数目,约为 个。
粒子的数目N= ;
1 mol H2约含 氢分子。
1 mol SO42-约含 个硫酸根离子,
约含 个氧原子。
2. 1 mol粒子的数目又叫阿伏加德罗常数,符号为 ,单位 。
1. 物质的量是一个物理量,符号为 ,单位为 。注意:使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子。
8.(14分)如图是某同学利用日常用品注射器设计简易实验装置。甲管中注入10 mL CH4,同温同压下乙管中注入 50 mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管用日光照射一段时间。
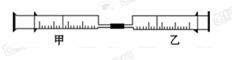
(1)下列是某同学预测的实验现象:
①气体最终变为 无色;②实验过程中,甲管活塞向内移动; ③甲管内壁有油珠;④产生火花。其中正确的是_____ 。
无色;②实验过程中,甲管活塞向内移动; ③甲管内壁有油珠;④产生火花。其中正确的是_____ 。
(2)甲管中发生的化学反应类型为_____ 。
(3)反应后,甲管中剩余气体能用下列试剂吸收的是___。
A.水 B.氢氧化钠溶液
C.硝酸银溶液 D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到_____ ,若再向其中滴入几滴石蕊试液,又观察到_____ 。
[解析]在光照下,甲烷与氯气发生连锁反应:
CH4+Cl2 CH3Cl+HCl,CH3Cl+Cl2
CH3Cl+HCl,CH3Cl+Cl2 CH2Cl2+HCl,
CH2Cl2+HCl,
CH2Cl2+Cl2 CHCl3+HCl,CHCl3+Cl2
CHCl3+HCl,CHCl3+Cl2 CCl4+HCl。
CCl4+HCl。
(1)理论上,甲烷与氯气体积比为1∶4时二者恰好完全反应,而该针管里氯气与甲烷体积比为5∶1>4∶1,说明氯气过量,最终气体中仍有氯气。该反应进行缓慢,不会产生火花。产物中只有氯化氢和一氯甲烷为气体,所以气体的总物质的量减小,内部压强减小,甲管活塞向内移动。(2)甲烷分子中的四个氢原子可被氯原子逐一取代,故甲管中发生的是取代反应。(3)剩余气体中含有氯气和氯化氢,可用氢氧化钠溶液吸收剩 余气体。
余气体。
(4)生成的HCl会与AgNO3反应生成AgCl白色沉淀,同时因CH2Cl2、CHCl3、CCl4难溶 于水而看到液体分为两层,若加入几滴石蕊,溶液会变红。
于水而看到液体分为两层,若加入几滴石蕊,溶液会变红。
答案:(1)②③
(2)取代反应
(3)B
(4)液体分为两层,产生白色沉淀 溶液变红色
7.(9分)(2010·三明高一检测)CH4和O2(过量)混合气体840 mL(标准状况下),经电火花点燃充分反应,将反应后的气体(120 ℃)通过足量碱石灰(充分吸收CO2和H2O) ,碱石灰增重0.60 g。
,碱石灰增重0.60 g。
(1)原混合气体中CH4的物质的量为_______。
(2)通过足量碱石灰后剩余气体的体积为_______ (标准状况下)。
(3)打火机中的燃料是丁烷(C4H10),写出丁烷完全燃烧的化学方程式: _______ 。
[解析]设原混合气体中CH4的物质的量为x,则有
CH4+2O2 CO2+2H2O
CO2+2H2O
X 2x x 2x
所以44 g/mol·x+18 g/mol·2x=0.60 g
解得x=0.007 5 mol,因此原混合气体中CH4与O2的总物质的量为0.007 5 mol×3=0.022 5 mol,即504 mL,所以剩余气体的体积为840 mL-504 mL=336 mL。丁烷分子式为C4H10,完全燃烧产物为CO2和H2O,据原子守恒配平即得化学方程式。
答案:(1)0.007 5 mol (2)336 mL
(3)2C4H10+13O2 8CO2+10H2O
8CO2+10H2O
[实验·探究]
6.(7分)如图,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题:
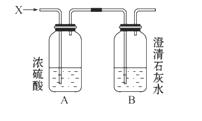
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是___________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是____________。
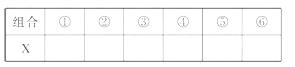
(3)若A,B两个洗气瓶的质量都增加,试推测X可能有几种组合,填写下表。(有多少种写多少种,不必填满)
[解析]H2、CO、CH4燃烧的产物分别是H2O(g)、
CO2(g)、CO2(g)和H2O(g)。H2O(g)可被浓H2SO4吸收,CO2可被澄清石灰水吸收。根据洗气瓶质量的变化,可判定生成的产物 答案:(1)H2 (2)CO
答案:(1)H2 (2)CO
(3)①CH4 ②CH4与H2 ③CH4与CO
④H2与CO ⑤CH4、H2和CO
5.在标准状况下,22.4 L CH4与氯气在光照下发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗的氯气为( )
A.0.5 mol B.2 mol C.2.5 mol D.4 mol
[解析]选C。1 mol  CH4与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4各0.25 mol,该四种取代物中n(Cl)=0.25 mol×(1+2+3+4)=2.5 mol,根据取代反应特点,1/2的氯原子进入氯化氢,所以n(HCl)=2.5 mol,故生成物中所含氯原子共2.5 mol+2.5 mol=5
mol,参加反应的氯气为n(Cl2)=2.5 mol。
CH4与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4各0.25 mol,该四种取代物中n(Cl)=0.25 mol×(1+2+3+4)=2.5 mol,根据取代反应特点,1/2的氯原子进入氯化氢,所以n(HCl)=2.5 mol,故生成物中所含氯原子共2.5 mol+2.5 mol=5
mol,参加反应的氯气为n(Cl2)=2.5 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com