
题目列表(包括答案和解析)
5. 用两支惰性电极插入500mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(电解时阴极没有氢气放出,且电解液在前后体积变化可以忽略),电极上析出的质量大约是
A. 27mg B. 54 mg C. 108 mg D. 216 mg
4、要对热稳定的高沸点液态有机物和低沸点的杂质的混合物进行提纯一般使用的方法
A、重结晶 B、蒸馏 C、过滤 D、萃取
3. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl - -2e -==Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH -
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- == Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - == Fe2+
2. 铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,可能出现的现象是
A. 铁棒附近产生OH- B. 铁棒逐渐被腐蚀
C. 石墨棒上放出Cl2 D. 石墨棒上放出O2
1.某烯烃与氢气加成后得到2,2-二甲基丁烷,该烃的名称是
A.3,3-二甲基-1-丁炔 B.2,2-二甲基-2-丁烯
C.2,2-二甲基-1-丁烯 D.3,3-二甲基-1-丁烯
23.(10分)(Ⅰ)(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3) 常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_________。(填“>7”、“<7”、或“无法确定”)
(Ⅱ)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
|
化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
|
颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
|
Ksp |
1.8×10-10 |
5.0×10-13 |
8.3×10-17 |
2.0×10-48 |
1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A. KBr B. KI C. K2S D. K2CrO4
22.(10分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ;该元素的符号是 。
(2)Y元素原子的价层电子的电子排布图为 。
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是 ;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性
21.(10分)(1)工业合成氨反应中,每生成0.1摩尔氨放热4.62KJ,该反应的热化学方程式为 。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)=1.2mol, n(H2)=1.2mol, n(NH3)=0.8mol,则反应速率V(N2)= mol·L-1·min-1,H2的转化率= ,。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左﹑向右或不移动)移动,平衡常数 (填增大、减小或不变)。
3.乙池中反应的化学方程式为______________________________
当乙池中B(Ag)极质量增加5.4g,甲池中理论上消耗O2的体积为____________________L
(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
2.写出通入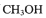 的电极的电极反应式_________________________
的电极的电极反应式_________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com