
题目列表(包括答案和解析)
8.下列叙述中正确的是 A.钠呈银白色、质软、熔点相对较低、密度比水小,灼烧时火焰呈紫色 B.在铝和氢氧化钠溶液的反应中,氧化剂是H2O和NaOH C.食盐溶解在酒精中形成的分散系是悬浊液 D.在标准状况下,1 mol任何气体所占的体积都约是22.4 L
5.下列叙述中,错误的是 A.虽然固体氯化钠不能导电,但氯化钠是电解质 B.纯水的pH随温度的升高而减小 C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大 D.在纯水中加入少量硫酸铵,可抑制水的电离 6.下列说法不正确的是 A.根据沸点差异可以判断两种液体混合物是否可用蒸馏方法进行分离 B.根据固体溶解度曲线可以判断物质结晶的方法 C.根据熵变可以判断所有化学反应能否自发进行 D.根据化学平衡常数可以判断化学反应进行的限度 7.判断下列化学基本概念的依据不正确的是 A.溶液的酸碱性:溶液中c(H+)和c(OH-)的相对大小 B.强弱电解质:溶液的导电能力大小 C.离子化合物:化合物中是否含离子键 D.氧化还原反应:元素化合价是否变化
4.下列说法正确的是 A.烧碱和纯碱都是碱 B.CH4和CO2都是共价化合物 C.等体积的O2和O3具有相同的分子数 D.因为NH4Cl是强电解质,所以在其水溶液中只存在水解平衡,不存在电离平衡
3.如果你家里的食用花生油混入了大量的水,利用你所学的知识,采用最简便的分离方法是
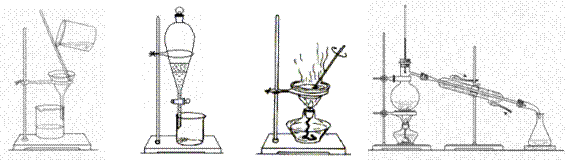 A
B
C
D
A
B
C
D
1.0.1mol/L NaHCO3溶液的pH最接近于 A.5.6 B.7.0 C.8.4 D.13.0 2.若N60是与C60相似的另一种“分子足球”,下列说法正确的是 A.N60分子中只含有共价键 B.N60和14N都是氮的同位素 C.N60是一种新型化合物 D.N60与N2互为同分异构体
20.(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+
e-
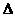 H1=1175.7
kJ·mol-1
H1=1175.7
kJ·mol-1
PtF6(g)+e-=PtF6-(g)
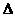 H2=-771.1
kJ·mol-1
H2=-771.1
kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)
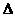 H3=482.2
kJ·mol-1
H3=482.2
kJ·mol-1
则反应O2(g)+PtF6(g)
= O2+PtF6-(s)的 H=_____________ 。
H=_____________ 。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);
用含a的代数式表示NH3·H2O的电离常数Kb=
19.(10分)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
 (3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
 (4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)
25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=
。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)
25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=
。
18. (10分)甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
|
组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
|
物质的量/mol |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

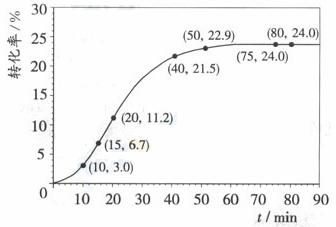
(1) 请计算15-20min范围内甲酸甲酯的减少量为
mol,甲酸甲酯的平均反应速率为 (不要求写出计算过程)。
请计算15-20min范围内甲酸甲酯的减少量为
mol,甲酸甲酯的平均反应速率为 (不要求写出计算过程)。
(2)向平衡后的溶液中加入一定量的水平衡 移动。
(3)上述反应的平衡常数表达式为: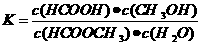 ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。(画出大体走势即可)
17. (18分)科学家一直致力于“人工固氮”的新方法研究,目前合成氨工业的核心反应是:
(18分)科学家一直致力于“人工固氮”的新方法研究,目前合成氨工业的核心反应是:
 N2 (g)
+ 3H2 (g)
N2 (g)
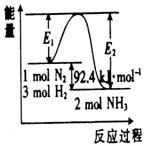
+ 3H2 (g) 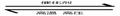 2NH3(g);△H=Q kJ·mol-1。反应过程中能量变化如图所示,请回答下列问题:
2NH3(g);△H=Q kJ·mol-1。反应过程中能量变化如图所示,请回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化:
E1 ,E2 ,Q 。(填“增大”“减小”“不变”)
(2)在5000C、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量 (填 “大于”、“小于”或“等于”)46.2kJ。
(3)在恒温恒压下,欲提高合成氨反应中H2的转化率,下列措施可行的是 (填字母)
A. 向容器中按比例再充入原料气 B. 向容器中再充入一定量H2
C. 使用新型催化剂 D. 分离出氨
 (4)根据最新“人工固氮”的研究报道,在常温常压、光照条件下,N2在催化剂(掺有少量的Fe2O3的TiO2)表面与水发生反应:N2 (g)
+ 3H2O(l)
(4)根据最新“人工固氮”的研究报道,在常温常压、光照条件下,N2在催化剂(掺有少量的Fe2O3的TiO2)表面与水发生反应:N2 (g)
+ 3H2O(l)  2NH3(g) +
2NH3(g) +
 O2
(g);△H= a kJ·mol-1。进一步研究NH3生成量与温度的关系,在常压下达到平衡时测得部分实验数据如下表:
O2
(g);△H= a kJ·mol-1。进一步研究NH3生成量与温度的关系,在常压下达到平衡时测得部分实验数据如下表:
|
T/K |
298 |
313 |
323 |
|
NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
①此合成反应中的a (填“>”、“<”或“=”)0。
②若在常温常压下改变一个实验条件(温度、压强、催化剂)得到NH3生成量随时间变化的曲线1、2、3(如图所示),则曲线1、2、3所对应的实验条件改变分别是:1. ,2. ,3. 。
15、如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。
其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,
起始时容器体积均为VL,发生如下反应并达到平衡
(X、Y状态未知):2X(?) + Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间Ⅰ>Ⅱ
D.平衡时Ⅰ容器的体积小于VL
16. 盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是 ( )
A.NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO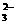 和OH-
和OH-
 B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
 D.中和体积与pH都相同的HCl和CH3COOH溶液所消耗的NaOH物质的量相同
D.中和体积与pH都相同的HCl和CH3COOH溶液所消耗的NaOH物质的量相同
填空题部分(每空2分,共52分。将答案填在答题纸上。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com