
题目列表(包括答案和解析)
1.(1)D(2)降低;小于;增大体积使CO2压强减小,平衡向右移动,因正反应吸热,故使体系温度降低,重新平衡时,CO2压强必小于850℃时平衡压强
14.(1)8(2)2(3)正 15.x = 3
拓展提高
12.(1)= (2)<(3)>(4)< 13.(1)低温,加压(2)高温,低压
1.D 2.C 3.A 4.C 5.B 6.C 7.D 8.B 9.B 10.BC 11.C
3.已知T℃、P kPa时,在容积为V L密闭容器中充有1molA和1molB。保持恒温恒压,使反应:A(g) + B(g) 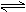 C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器中充入2molA和2molB,则反应达到平衡时,容器的容积为________,C的体积分数为_______。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1molA和1molB反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为________。
科学前沿
“压”出来的变化
由于固体、液体的体积受压强影响较小,当一个平衡体系中只有固体或液体时,可以认为改变压强平衡不移动。然而,这一结论仅适用于在一定范围内改变压强,如果压强的增大超过一定限度,则常常会出现一些奇妙而有趣的变化。
我们知道石墨和金刚石互为同素异形体,它们的密度分别为2.22g.cm-3和3.51g.cm-3。根据化学平衡移动原理,增加压强应有利于金刚石的合成,科学家为此进行了长达数十年的探索。终于,在20世纪50年代,美国通用汽车公司利用高温(2000℃)、高压(20000atm)将石墨转化为了金刚石。此后,许多科学家对这种超高压的神奇作用产生了浓厚的兴趣。1989年,日本科研人员有别处心裁地将炸药和炭粉混合并用石蜡固化后装入钢制敞口容器,沉入一个直径8m,深约5m的混凝土制水槽内(防止炭被空气中的氧气氧化),点火起爆,最后将容器中的水取出静置,获得了直径为0.002μm ~ 0.003μm的金刚石粉末,巧妙地利用了爆炸瞬间产生的超高压(40万个大气压)。同样利用高温、高压,科学家还把常温常压下跟石墨一样很软很滑的六角结构的氮化硼(俗称白石墨)合成了立方结构的氮化硼,其硬度仅次于金刚石。这种人造的超硬材料被称为工业的牙齿,制成磨具、刀具用来加工石材、钢材,大大提高了加工效率。
氢能是一种高效无污染的新能源,但其缺点是储存时所占的体积过大。科学家设想:既然氢与锂、钠、钾等同属ⅠA族元素,如果给氢分子加上高压,将氢分子压跨,每个氢原子的电子就可能和临近的原子核十分接近而成为所有的氢原子共同占有的自由电子,非金属氢转变成金属氢。而一旦得到稳定的金属氢,人们便获得一种高能量密度的无污染能源。美国华盛顿卡内基研究所的毛何匡和鲁塞尔.赫姆利根据这一分析,并通过艰苦努力,终于用250万个大气压在-196℃的条件下将气体“氢”压成了金属氢,不过,当压力解除后,金属氢又变成了普通氢气,科学家相信这一难题必将被攻克,孕育中的金属氢一定会成为人类最理想的高效能源材料。与此类似,科学家还将稀有气体Xe在低温高压下变成了绝缘固体后,又进一步将温度降至77K,压力升至132,Xe变成了具有金属导电性的金属氙。物质受到这种超高压的作用,除发生上述变化外还可能引起物质导电性的突变,如锗在常温常压下是半导体,当锗受到高压作用后会转变为白锡结构而具有超导性,这给科学家研究超导现象开创了新的领域。由此可见,在超高压作用下的物质不仅可能发生原子结构的变化,还有可能发生电性质的变化。
此外,高压研究的另一个重要的方面是高压引起的物质相变。水在常温下是液体,但在高压下会变成固体,科学研究表明在小于200 GPa的高压范围内,水有8个高压相,即8种不同的冰。高压对物质的熔点也会产生影响,对固态熔化成液态体积增大的物质,增加压强,熔点升高。如水银的熔点在1atm下为-39℃,而在15000atm下为10 ℃。对熔融时体积缩小的物质,压强增大,熔点降低,如冰在1atm下熔点是0℃,实验证明,每增加134atm,冰的熔点降低1℃。目前,物质在高压条件下的变化研究已日渐成为人们关注的热点课题之一。
非平衡态化学
长期以来,物理学家认为自发过程总是使体系趋于平衡。有序原理是唯一的支持从无序列到有序的物理学原理,但当用这个有序原理来解释生物学现象时却碰到了很大麻烦。按照几率观点,生物有序状态的形成是一种高度不可几的事件。大家都知道,自然界中约有20种不同的氨基酸,一个蛋白质分子可以包括成千上万个氨基酸,这成千上万个氨基酸分子可以有许多种不同的排列方式,假定各种排列方式的出现几率是相等的,那么形成某种特定氨基酸排列方式的蛋白质分子的几率是极小的。假如蛋白质分子中的氨基酸排列方式可以自动调整,若要得到一个具有特定结构的蛋白质分子,需要等待的时间长得不可想象。比方说一个具有100个氨基酸的蛋白质分子,这些氨基酸分子中包括20个不同的种类,那么这100个氨基酸分子可有多达约10130种不同的排列方式。假定蛋白质分子每秒可变换其氨基酸分子的排列方式有100万次(实际上显然不可能这么快), 那么要形成一个特定结构的蛋白质分子, 需要等待长达10124秒,而根据目前资料表明地球的年龄才只有1017秒,因此上面的推理显然不正确。这清楚地说明根本不可能用有序原理的几率概念来解释生物有序的现象。实际上即使在无生命界也能发现许多自发形成的有序结构现象,比如天空中时而形成的鱼鳞状白云,一些岩石的规则花纹,松花蛋中的漂亮“松花”等等。这些自组织现象显然是一种高度不可几事件,只能用非平衡原理来解释。 按照经典热力学的观点,非平衡只是一种暂时的现象,不可逆过程总是起一种耗散能量和破坏有序结构的作用。为了描述实际体系和实际过程必须抛弃热力学方法而采用动力学的方法。在某些条件下,体系通过和外界环境不断交换物质和能量以及通过内部的不可逆过程(能量耗散),无序态有可能失去稳定性,某些涨落可被放大而体系达到某种有序的状态,这种有序状态被称为耗散结构(Dissipative Structure),因为他们的形成需要能量的耗散。 耗散结构这一新概念的确立,使得人们对自然界的发展规律有了更完整的认识,它第一次使人们认识到非平衡态和不可逆过程也可以在建立有序方面起到积极的作用。这不仅有利于人们认识自然界中的各种有序现象,也有利于去利用这些有序现象,因而它展示了广阔的应用前景。
大气臭氧层中的化学平衡
地球表面有大气层覆盖,离地面大约12km以上的高空中有一臭氧层(实质是臭氧浓度较高些),它是地球生命的保护屏障。
我们知道,太阳辐射对生命危害极大的是紫外线。当太阳辐射通过臭氧层时,被吸收了约90%的紫外线,或者说把这些紫外辐射能量转变为热量,使地面生命免受伤害。这其中的奥妙就在于臭氧层中存在以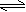 下动态平衡的缘故: O2 + O O3
下动态平衡的缘故: O2 + O O3
现在来分析臭氧层中的这一平衡是怎样建立的,又怎样把紫外辐射能转变为热能的。
首先,太阳辐射把高空的氧气分子分裂为2个氧原子,性质异常活泼的氧原子跟氧气分子结合成臭氧:
O2→O + O O2+ O→O3
然后,在紫外线作用下,臭氧转化成氧气,并放出热量:2O3→3O2 ;△H<0
这一反应被看做臭氧能吸收紫外线,即从能量角度看,相当于把紫外辐射能转变成热能。
臭氧分解而生成氧气,又会被太阳辐射作用生成氧原子,氧原子又会和氧气分子结合成臭氧,臭氧又吸收紫外线分解成氧,所以在臭氧层中,O3、O2和O处于动态平衡,构成了地球生命免受紫外线杀伤的天然屏障。
w。w-w*k&s%5¥u
第4节 化学反应条件的优化--工业合成氨
基础训练
2. 在一定条件下,用CO和H2为原料合成甲醇,其反应方程式为:CO +2H2 CH3OH(g)。当原料气中H2和CO的比例不同时,对CO的转化率以及平衡混合物中CH3OH的体积分数都有影响。
在一定条件下,用CO和H2为原料合成甲醇,其反应方程式为:CO +2H2 CH3OH(g)。当原料气中H2和CO的比例不同时,对CO的转化率以及平衡混合物中CH3OH的体积分数都有影响。
(1)以m表示H2和CO的物质的量之比(即H2:CO= m:1),α表示CO的平衡转化率,x为平衡中CH3OH的体积分数,则x =_______________
(2)下表列出m = 1,2,3,4时部分实验数据,据此数据得出反应物的比例对CO转化率(α)以及平衡混合物中CH3OH的体积分数(x)产生影响的结论,并在实际生产中选择最佳的反应配比。
|
m |
1 |
2 |
3 |
4 |
|
α |
0.25 |
0.45 |
0.56 |
0.62 |
|
x |
16.7 % |
21.5 % |
19.4 % |
16.4 % |
①所得结论是___________________________________;
②反应物的最佳配比是__________。
1.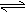 反应CaCO3(s) CaO(s)
+ CO2↑在不同温度下CO2的平衡压强如下表:
反应CaCO3(s) CaO(s)
+ CO2↑在不同温度下CO2的平衡压强如下表:
|
温度/℃ |
550 |
650 |
750 |
850 |
897 |
|
压强/Pa |
5.32×101 |
9.17×102 |
8.37×103 |
4.94×104 |
1.01×105 |
(1)若升高原CaCO3分解平衡体系的压强,同时给反应容器加压,则原平衡( )
A.向左移动 B.向右移动 C.不移动 D.无法确定平衡移动
(2)在一个与外界不能进行热交换的密闭容器中,足量的CaCO3在850℃时建立了分解平衡。若将该容器的容积扩大为原来的2倍,当重新达到平衡时,容器内的温度将________,CO2的平衡压强将______4.94×104(>,<,=),理由是____________________________。
15.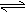 一定条件下,将1mol A投入容积为1 L的密闭容器中发生如下反应:2A(g)
B(g) + x C(g);
一定条件下,将1mol A投入容积为1 L的密闭容器中发生如下反应:2A(g)
B(g) + x C(g);
ΔH>0,经t min,反应达到平衡,此时A的转化率为p%,容器内压强也增大p%。计算该反应方程式中的x值。
拓展提高
14. 对于反应aA + bB c C
+ d D,瞬时速率V (正)= k1C(A)a .C(B)b。将4 mol SO2和2mol O2充入容积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%,则:
对于反应aA + bB c C
+ d D,瞬时速率V (正)= k1C(A)a .C(B)b。将4 mol SO2和2mol O2充入容积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%,则:
(1)起始时正反应速率是平衡时的_____倍。
(2)500℃时该反应的平衡常数K=________。
(3)在温度不变时再向平衡体系中加入2mol SO3、2mol O2和4 mol SO2,平衡将向________移动。
13.合成氨工业的原料气中含有少量CO,CO会使催化剂中毒,因此,在进入合成塔前必须将其除去。一般用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO,其反应为:
 Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac
·CO ΔH<0
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac
·CO ΔH<0
(1)醋酸二氨合铜(Ⅰ)吸收CO的生产适宜条件是_____________;
(2)吸收CO后的醋酸铜氨溶液经处理后可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产适宜条件是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com