
题目列表(包括答案和解析)
4、将 lmolSO2和 l mol O2 通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走 0.5mol O2和 0.5mol SO2则反应达到新的平衡时,SO3的物质的量是
A.0.3mol B.0.15mol
C.小于 0.15mol D.大于0.15mol而小于 0.3mol
3、在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
A.平衡向正反应方向移动了 B.平衡向逆反应方向移动了
C.物质B的质量分数增加了 D.a<b
2、下列变化过程中,ΔS<0的是
A.氯化钠溶于水中 B.NH3(g)和HCl(g)反应生成NH4Cl
C .干冰的升华 D.CaCO3(S)分解为CaO(S)和CO2(g)
.干冰的升华 D.CaCO3(S)分解为CaO(S)和CO2(g)
1、在2A+B 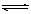 3C+4D反应中,表示该反应速率最快
3C+4D反应中,表示该反应速率最快 的是
的是
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
22、(13分)图为相互串联的甲、乙两电解池。
试回答:
(1)若甲电解池利用电解原理在铁上镀银,
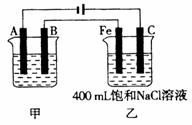 则A是 、填电极材料),
则A是 、填电极材料),
电极反应式 ;
B(要求同A)是 ,
电极反应式 ,应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。C极附近呈 色。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是
mL。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为
mol·L-1,溶液的pH等于 。
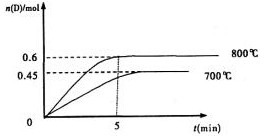
21、(12分)2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:
A(g)+2B(g)
 C(g)+D(g),
C(g)+D(g),
在不同温度下,D的物质的量n(D)和时间t的关系如图
试回答下列问题:
(1)800℃时。0-5min内,以B表示
的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的标志是 。
A.容器压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
E. 混合气体的平均分子量不再改变 F. 混合气体密度不变
G. A:B:C:D= 1:2:1:1
(3)利用图中数据计算800℃时的平衡常数K= ,B的平衡转化率为: 。
该反应为 反应(填吸热或放热)。
(4)800℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(A)=2.2mol,n(B)=5.2mol,n(C)=1.8mol,n(D)=1.8mol,则此时该反应
进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
20、(17分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的 中,然后再用蒸馏水稀释到所需的浓度。若用惰性电极电解AgNO3的水溶液,请写出电池反应的离子方程式 ,
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
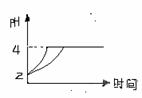 (3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向
 其中分别加入适量的Zn粒,反应过程中两溶液的pH变化
其中分别加入适量的Zn粒,反应过程中两溶液的pH变化
如右图所示。则图中表示醋酸溶液中pH变化曲线的是
(填“A”或“B”)。设盐酸中加入的Zn质量
 为m1,
醋酸溶液中加入的Zn质量为m2。则m1 m2
为m1,
醋酸溶液中加入的Zn质量为m2。则m1 m2
(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:负极:
正极: ;
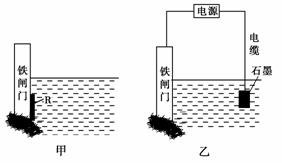
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________。
A.铜 B.钠
C.锌 D.石墨
 ③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
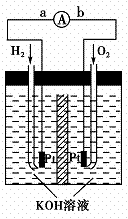
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
①氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
②负极反应式为 。
 ③电极表面镀铂粉的原因为 。
③电极表面镀铂粉的原因为 。
19、(4分)能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) ; 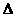 H=-570 kJ·mol-1;
H=-570 kJ·mol-1;
② H2(g)+1/2O2(g)=H2O(g) ; 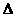 H=-242 kJ·mol-1
H=-242 kJ·mol-1
③ C(s)+1/2O2(g)=CO(g) ; 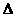 H= -110.5 kJ·mol-1
H= -110.5 kJ·mol-1
④ C(s)+O2(g)=CO2(g) ; 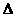 H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g) ; H= +890 kJ·mol-1
H= +890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO (g)  H=a kJ·mol-1;则a= ;该反应的熵
H=a kJ·mol-1;则a= ;该反应的熵 S
0(选填“>”、“=”、“<”)。
S
0(选填“>”、“=”、“<”)。
18、下列离子方程式书写正确的是
A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2 Fe3++Br2+4Cl-
B.用石墨电极材料电解NaCl饱和溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.向CaCl2溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3+2H+
D.醋酸与锌粒反应:2H++Zn2+=H2↑+Zn
第Ⅱ卷(46分)
17、常温下,将NH4NO3溶于水得到无色溶液,为使溶液中的c(NH4+):c(NO3-)=l:l,可采取的下列措施是
A.加入适量的HNO3,抑制NH4+水解 B.加入适量的氨水,使溶液的pH=7
C.加入适量的水稀释溶液 D.加入适量的NaOH,使溶液的pH=7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com