
题目列表(包括答案和解析)
4. 已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是( )
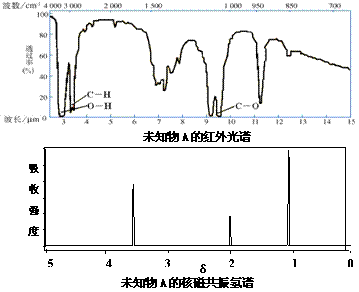
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1:2:3
C.仅由其核磁共振氢谱就可知其分子中的氢原子总数
D.若A的分子式为C2H6O,则其结构简式为CH3CH2OH
3.某有机物的结构简式如下,关于该有机物的下列叙述不正确的是 ( )
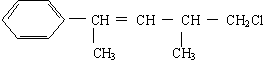
A.不能使酸性KMnO4溶液褪色 B.能使溴水褪色
C.在加热和催化剂作用下,最多能和4 mol H2反应
D. 一定条件下,能发生取代反应
2. 下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗氧气的质量不变的是( )
A.C3H8、C4H6 B.C3H6、C4H6O2 C.C2H2、C6H6 D.CH4O、C3H4O4
1. 下列四种烃的名称所表示的物质,命名正确的是( )
A.2-甲基-2-丁炔 B. 1,3,4-三甲苯 C.3-甲基-2-丁烯 D. 2-乙基-1-丁烯
30.将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀。当在铜片上放出6.72L(标准状况下)的气体时,H2S04恰好反应完全。
(1)原稀硫酸的物质的量浓度是 mol·L-1
(2)计算锌片减少的质量 g。
29.(12分)铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
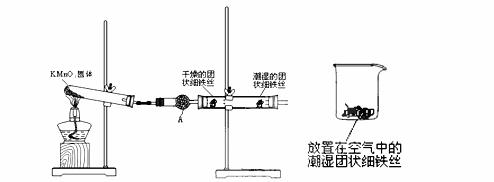
首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③中潮湿的铁丝依然光亮。
试回答以下问题:
(1)由于与接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于___________。
正极的电极反应为__________________________________________________
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如右图:
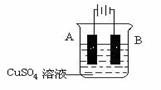 请回答:
请回答:
① B电极对应的金属是______(写元素名称),A电极的电极
反应式是 __
② 若电镀前铁.铜两电极的质量相同,电镀完成后, 若电镀
时电路中通过的电子为0.2mol,将它们取出洗净、烘干、
称量,则A、B两极质量相差________________ g。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
28.(12分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 ,电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式
是 。若电解电路中通过2mol电子,MnO2的理论产量为 g。
27. (12分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:
,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(12分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:
,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x =
(2)从反应开始到10s,B的平均反应速率为
(3)从反应开始到40s达平衡状态,A的平均反应速率为
(4)平衡时容器中B的体积分数为
(5)该温度下此反应的平衡常数数值是
(6)下列各项能表示该反应达到平衡状态是
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
26.(6分)有一部分化学反应的反应热测定起来很困难,我们可以根据盖斯定律计算获得。如同素异形体之间的转化反应热数值小且转化慢,测定较困难。已知:
①P4(s,白磷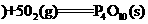
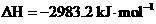
②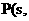 红磷
红磷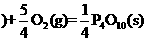
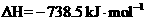
(1)白磷转化为红磷的热化学方程式___________ __。相同的状况下,能量较低的是_______;白磷的稳定性比红磷能量________(填“高”或“低”)。
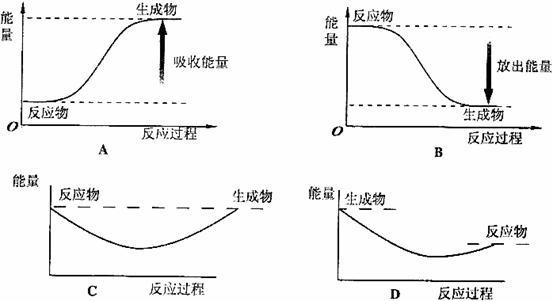
(2)对应下列反应过程中的能量变化图,能正确反映出白磷转化为红磷的是_______。(填序号)
25.(6分)(1)常温下14g CO在足量氧气中充分燃烧,放出141.3kJ热量,写出热化学方程式
(2)用惰性电极电解硫酸铜溶液时,阳极反应式是 ,总反应的离子方程式是____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com