
题目列表(包括答案和解析)
|
|
离子键 |
共价键 |
|
定义 |
离子键: |
|
|
共价键: |
||
|
形成过程 |
得失电子 |
共用电子对 |
|
成键微粒 |
|
|
|
成键元素 |
|
|
|
实例 |
|
|
|
表示方法 (任举一例) |
|
|
分子间作用力:定义
分子间作用力仅存在于由 构成的物质,它的作用力比化学键 (“强”或“弱”),分子间作用力是影响物质的 和 的重要因素之一。
能用电子式、结构式、结构简式表示常见微粒或物质
|
元素(原子)符号 |
Na |
Mg |
Al |
H |
O |
S |
F |
Cl |
|
原子电子式 |
|
|
|
|
|
|
|
|
|
离子符号 |
|
|
|
|
|
|
|
|
|
离子电子式 |
|
|
|
|
|
|
|
|
用电子式来表示以离子键结合的物质,
AB型:NaCl MgO (KCl CaO等)
A2B型:Na2O K2S (Na2S K2O等)
AB2型:MgCl2 CaCl2 (MgBr2 CaBr2等)
拓展: Na2O2 NaOH NH4Cl
用电子式、结构式来表示以共价键相结合的物质
单质 :H2 N2 (F2 Cl2等)
化合物:HCl H2O NH3 CH4
拓展: CO2 H2O2 CCl4
(三)A. 元素的金属性和非金属性强弱的比较(重点、难点)
|
金属性越强 |
非金属性越强 |
|
①原子半径越 ; |
①原子半径越 ; |
|
②单质的 性越强; |
②单质的 性越强; |
|
③与水或酸反应生成氢气越 ; |
③与氢气反应越 ;生成氢化物越 ; |
|
④最高价氧化物对应水化物 性越强。 |
④最高价氧化物对应水化物 性越强。 |
同周期与同主族的变化规律
|
|
|
同周期 (从左到右) |
同主族 (从上到下) |
|
结构 |
核电荷数 |
|
|
|
电子层数 |
|
|
|
|
最外层电子数 |
|
|
|
|
原子半径 |
|
|
|
|
性质 |
元素原子失电子能力 |
|
|
|
元素原子得电子能力 |
|
|
|
|
金属性 |
|
|
|
|
非金属性 |
|
|
|
|
金属单质与水或酸置换出H2 |
|
|
|
|
最高价水化物的酸、碱性 |
|
|
|
|
气态氢化物的稳定性 |
|
|
以第三周期、第IA 、ⅦA族为例:
第三周期:原子半径由大到小的顺序为
金属单质与水或酸置换出氢由易到难的顺序为 > >
最高价氧化物的水化物碱性由强到弱的顺序为 > >
金属性: > >
非金属单质与氢气反应由易到难的顺序为 > > >
气态氢化物的稳定性顺序为 > > >
最高价氧化物的水化物酸性由强到弱的顺序为 > > >
非金属性: > > >
第IA族:原子半径由小到大的顺序为
金属单质与水或酸置换出氢由易到难的顺序为 > > > >
最高价氧化物的水化物碱性由强到弱的顺序为 > > > >
金属性: > > > >
第ⅦA族:原子半径由小到大的顺序为
非金属单质与氢气反应由易到难的顺序为 > > > >
气态氢化物的稳定性顺序为 > > > >
最高价氧化物的水化物酸性由强到弱的顺序为 > >
非金属性: > > > >
(二)、元素周期律:
1.随着原子序数的递增,元素的 (除稀有气体元素外)、金属性和 、最高正价和最低负价、最外层电子数都呈现 变化。
2.元素的性质 的规律叫做元素周期律。
3.元素周期律是 随着元素核电荷数的递增发生周期性变化的必然结果。
(一)、原子结构与元素周期表的关系
原子序数= = =
周期序数= ;主族序数= =最高正价(O、F除外)
最高正价+|负价|= (H为2)
周期表结构
现行元素周期表的编排原则与特点:
周期:
族 :
 三短(第 、 、 周期)
三短(第 、 、 周期)
周期 个: 三长(第 、 、 周期)
一不全(第 周期)
 七主(A)(第
、 、 、 、 、 、 族)
七主(A)(第
、 、 、 、 、 、 族)
族 个: 七副(B)(第 、 、 、 、 、 、 族)
0和Ⅷ(3列)
(四)、画出1-18号元素的原子结构示意图
|
1 |
|
2 |
|||||
|
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
(三)、核外电子排布规律
在含有多个电子的原子中,能量低的电子通常在离核较 的区域内运动,能量高的电子通常在离核较 的区域内运动。据此可以认为:电子在原子核外距核由近 到远,能量是按由 到 的方式进行排布。通常把能量最 、离核最 的电子层叫第一层,由里往外以此类推,共有 个电子层,分别用字母 表示,每层最多容纳的电子数为 个,而最外层电子数不得超过 个(第一层为最外层时,电子数不超过 个),次外层不得超过 个
(二)、同位素: 同位素。
(要点)两同:质子数相同,同种元素;两不同:中子数不同,不同原子
如:氢元素的同位素有 ,碳元素的同位素有 ,
氧元素的同位素有 ,氯元素的同位素有 。
(一)、原子结构:
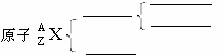
原子的表示方法: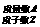
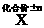
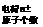 :
:
原子:核电荷数= = =原子序数
质量数 = + ≈相对原子质量
阳离子:(aAm+) 核外电子数=质子数 - 所带电荷数,即核外电子数=
阴离子:(bBn-) 核外电子数=质子数 + 所带电荷数,即核外电子数=
2.24×10-2 m3,该气体的物质的量为1 mol
B.1 mol某气体的体积为22.4 L,该气体所处的状况必定为标准状况
C.在20℃的温度下,1 mol某气体的体积约为22.4 L,该气体的压强为101 kPa
D.固态的二氧化碳又叫干冰,含CO2 1 mol的干冰在标准状况下的体积必定小于22.4 L
18.下列说法中正确的是 ( )
A.在0℃、1.01×105 Pa的条件下,某气体的体积约为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com