
题目列表(包括答案和解析)
4. 下列各组物质在只提供水和若干支试管的情况下,达不到鉴别目的的是( )
A.硝基苯、苯、乙醇三种液体
B.硫黄、Na2O2、CaCl2三种固体
C.H3PO4、Ba(OH)2、Ba3(PO4)2 三种固体
D.Na2SO4、KNO3、BaCl2三种固体
3. 某校课外活动小组的同学分别对四种溶液中所含的离子进行检测,下列所得结果,有错误的是 ( )
A.K+、Na+、 、
、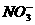 B.
B.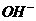 、CO32-、
、CO32-、 、K+
、K+
C.Ba2+、Na+、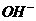 、
、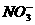 D.Ba2+、
D.Ba2+、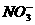 、
、 、
、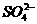
2.五颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是( )
①新制氯水久置后→浅黄绿色消失; ②淀粉溶液遇单质碘→蓝色;
③溴化银见光分解→银白色; ④热的黑色氧化铜遇乙醇→红色
⑤鸡蛋白溶液遇浓硝酸→黄色; ⑥苯酚在空气中氧化→粉红色
A.①②③④⑤ B.②③④⑤⑥ C.①②④⑤⑥ D.①③④⑤⑥
1.根据下列实验现象,所得结论正确的是( )
 A
B
C
D
A
B
C
D
|
实验 |
 实验现象 实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
 溶解性AgCl>AgBr>Ag2S 溶解性AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
13. 解析:(1)由于环己烯沸点较低,容易挥发,为防止逸出,因此采用冰水冷却。
(2)①环己醇和环己烯密度均小于水;为了洗涤其中的环己醇和酸性杂质,选用能中和酸的Na2CO3溶液;KMnO4溶液可把环己烯氧化。
②发生CaO+H2O===Ca(OH)2反应,防止水随环己烯一起逸出而被收集。
③比理论产量低是由于损失了环己醇,与开始的用量无关。a项得到的质量会
高于环己烯的实际产量。
(3)根据官能团特性,在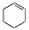 中检验
中检验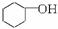 主要考虑醇羟基的性质,选b;
由于其中环己醇含量很少,用测沸点的方法不可行。
主要考虑醇羟基的性质,选b;
由于其中环己醇含量很少,用测沸点的方法不可行。
答案:(1)①防止暴沸 冷凝 ②使生成的环己烯变为液体,防止挥发
(2)①上 c ②g 吸收生成的水,防止水蒸气随环己烯一起蒸出 ③83℃ c (3)b
12.解析:由A、C两溶液的pH>7,结合离子共存可推知,A、C为Ba(OH)2、 CH3COONa中的一种,又由A、B溶液中水的电离程度相同,知A、B水解程
度相近,即水解形成的弱酸或弱碱的电离程度相近,进而推知A、B为CH3COONa、NH4Cl中的一种,再结合C溶液和D溶液相遇时只产生白色沉淀、
B溶液和C溶液相遇时只产生刺激性气味的气体、A溶液和D溶液混合时无明显
现象,推出A为CH3COONa,B为NH4Cl,C为Ba(OH)2,D为Na2SO4。当B、
C混合时,发生反应NH+OH-===NH3↑+H2O,故等体积等物质的量浓度的
NH4Cl与Ba(OH)2混合时,各离子浓度由大到小的顺序为:c(OH-)>c(Ba2+)=
c(Cl-)>c(NH)>c(H+)。
答案:(1)CH3COONa NH4Cl Ba(OH)2 Na2SO4
(2)c(OH-)>c(Ba2+)=c(Cl-)>c(NH)>c(H+)
11.解析:根据实验流程知第②步用盐酸把Fe3+、Al3+、Ca2+从固体物质浸出。第③步得到含有Ca2+、Al3+、Fe3+的溶液。第④步控制pH为6-7时,Fe(OH)3、Al(OH)3 完全沉淀。第⑥步生成CaC2O4沉淀。第⑧步是利用SCN-检验Fe3+的存在。溶液 2控制pH为4-5时,Fe(OH)3完全沉淀,铝元素以Al3+形式存在。
答案:(1)使Ca2+、Al3+、Fe3+溶解在盐酸中 (2)Ca2++(NH4)2C2O4===CaC2O4↓ +2NH
(3)Fe(OH)3、Al(OH)3 (4)Fe3++3SCN-===Fe(SCN)3 (5)使Fe3+转化为Fe(OH)3 沉淀 检验Al3+的存在
13.某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: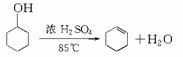
|
|
密度(g·
cm-3) |
熔点(℃) |
沸点℃ |
溶解性 |
|
环己醇 |
0.96 |
25 |
161 |
能溶于水 |
|
环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
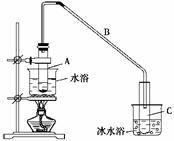
(1)制备粗品:将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品:①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,
振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用
________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________口进入。蒸馏时加入生石灰,
目的是__________________________________。
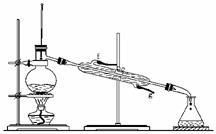
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
a.用酸性高锰酸钾溶液 b.用金属钠
c.测定沸点
检测一
1----5 CBCCD 6----10 AADCB
12.有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只
含一种阴离子且互不重复)
|
阳离子 |
Na+、Ba2+、NH |
|
阴离子 |
CH3COO-、Cl-、OH-、SO |
已知:①A、C溶液的pH均大于7,A、B两溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性
气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是__________,B是__________,C是________,D是________;
(2)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子
浓度由大到小的顺序为:
__________________________________________________________。
11.茶是我国人民喜爱的饮品。某校化学兴趣小组的 同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
[查阅部分资料] 草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。 Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH ≥5.5;Fe(OH)3: pH≥4.1。
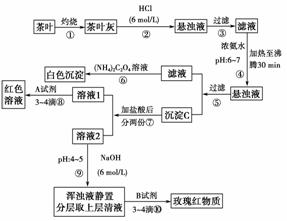
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 ________________________________________________。
(2)写出检验Ca2+的离子方程式 ___________________________________________。
(3)写出沉淀C所含主要物质的化学式 ______________________________________。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 ______________________________________________________________________。
(5)步骤⑨的作用是 ________________________________________________________,
猜测步骤⑩的目的是 _______________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com