
题目列表(包括答案和解析)
3.下列物质中,导电性能最差的是
A.熔融氢氧化钠 B.固体硝酸钾 C.盐酸溶液 D.石墨棒
2.下列关于pH试纸的使用方法合理的是
A.用pH试纸检验NH3的性质时,必须先将试纸润湿
B.用湿润的pH试纸测量KOH溶液时,结果偏大
C.用pH试纸测量某溶液时,其读数为5.3
D.用pH试纸测量某溶液时,可将试纸直接插入溶液中
1.2011年3月26日,在我国黑龙江省东北部空气中发现了极微量的人工放射性核素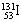 ,但这些极微量的放射性物质对我国环境和公众健康不会产生影响。该同位素原子的中子数和质子数之差是
,但这些极微量的放射性物质对我国环境和公众健康不会产生影响。该同位素原子的中子数和质子数之差是
A.78 B.53 C.25 D.131
21.由人尿分离出来的结晶化合物A,熔点为187~188℃。对A做下列实验:
⑴ 测得A的蒸汽密度为8.0g/L(已折合成标准状况)。取17.92g A完全燃烧,生成的气体通过浓硫酸,增重8.10g;剩余气体再通过碱石灰,增重39.60g。另取17.92g A完全分解,可得标准状况下的氨气1.12L。试求A的分子式。
⑵ 又知A和足量6mol/L盐酸混合加热可以完全水解,1mol A水解成1mol B和1mol C,已知A、B、C三物质均含一个羧基,B仅由C、H、O三种元素组成,其物质的量之比为7:6:2,C俗名甘氨酸。试推断A的结构。
20.(7分)化工行业已合成一种硬度比金刚石还大的晶体碳氮化合物,若已知氮在化合物中是-3价,推断:
⑴ 其分子式可能是_____________。
⑵ 试分析其硬度比金刚石还大的主要原因是______________________________________
____________________________________________________________________________。
⑶ SiC晶体的类型与金刚石相同,若将金刚石晶胞中的一半C原子换成Si原子,同时将C原子和Si原子通过共价单键交替连接,则构成SiC晶胞。试仿照上述SiC晶体结构的叙述,描述SiO2晶体的结构:若将金刚石晶胞中____________________________________________
____________________________________________________________________________。
⑷ 下列表达式中,既能叫做化学式又能叫做分子式的是_________________
A.SiO2 B.CO2 C.Na2O2 D.P4
19.(11分)
⑴ 短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第 族。
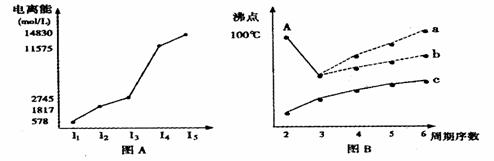
⑵ 图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: ,理由是:________________________
____________________________________________________________________________。
⑶ 人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
① 22Ti元素基态原子的价电子层排布式为 。
② 金属钛的堆积方式是__________________。
 ③ 钛合金,密度小、比强度高、耐腐蚀性强,用于涡轮发动机和飞机构架,其缺点是在一定条件下会燃烧,目前阻燃钛合金是工程实用化的主攻方向。钛合金在物质分类中属于____________________(填“混合物”或“化合物”)。
③ 钛合金,密度小、比强度高、耐腐蚀性强,用于涡轮发动机和飞机构架,其缺点是在一定条件下会燃烧,目前阻燃钛合金是工程实用化的主攻方向。钛合金在物质分类中属于____________________(填“混合物”或“化合物”)。
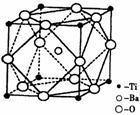
④ 在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。
18.(12分)氮是地球上极为丰富的元素。
⑴ 已知H-H键的键能为436kJ·mol-1,N≡N键的键能为946kJ·mol-1。根据热化学方程式:N2(g) + 3H2(g) === 2NH3(g) ΔH= -92 kJ·mol-1;则N-H键的键能为 。
A.360 kJ·mol-1 B.391 kJ·mol-1
C.618 kJ·mol-1 D.1173 kJ·mol-1
⑵ (CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂______(填“大”或“小”),可用作_______(填代号)。
A.助燃剂 B.“绿色”溶剂
C.复合材料 D.绝热材料
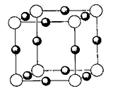
⑶ X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的
晶体结构如右图所示。X的元素符号是_______,每个N3─周围与之
等距离且最近的X+有 个。
⑷ 工业上以氨为原料,合成硝酸,尾气可用纯碱溶液吸收,有关的化学反应为:
㈠ 2NO2 + Na2CO3 === NaNO2 + NaNO3 + CO2
㈡ NO + NO2 + Na2CO3 === 2NaNO2 + CO2
① 根据反应㈠,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
② 配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
③ 现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。计算吸收液中NaNO2和NaNO3物质的量之比。
17.(8分)中国古代四大发明之--黑火药,它的爆炸反应为:
KNO3 + C + S -- K2S + N2↑+ CO2↑(未配平)
⑴ 请配平上述化学反应方程式,该反应中的氧化剂是 。
⑵ 除S外,上述反应中所涉及元素的电负性从大到小依次为 。
⑶ 在生成物中,K2S的晶体类型为 。
⑷ 已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为 。
16.(6分)据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
⑴ 下列有关O4的说法正确的是:
A.O4分子内共有4个质子,32个电子
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
⑵ 制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
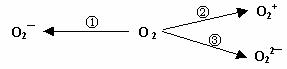
上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
⑶ 写出O22-的电子式:
15.(8分)A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有3个电子。
⑴ C原子的基态电子排布式为_______________,若A元素的原子最外层电子排布为1s1,
则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于_____键。
⑵ 当n=2时,元素A在周期表中的位置是______________________,属于_____区元素;
B的原子结构示意图为__________,B与C形成的化合物的电子式为______________。
⑶ 当n=3时,B与C形成的晶体中微粒间的作用力是__________,此时 A、B、C、D四
种元素的第一电离能由大到小的顺序是____________________(用元素符号表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com