
题目列表(包括答案和解析)
31、(10分)25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示。已知达平衡后,降低温度,A的转化率将增大。
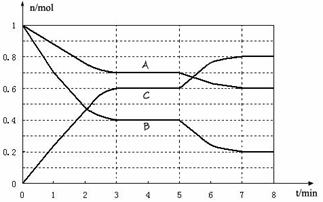
(1)根据上图数据,写出该反应的化学方程式____________________;此反应的平衡常数表达式K= 。从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)下图表示此反应的反应速率v和时间t的关系图
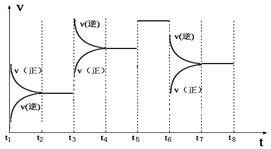
根据上图判断,在t3和t6时刻改变的外界条件分别是_____________和______________。
30、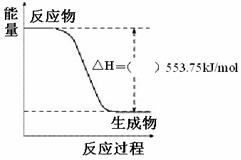 (10分)⑴北京奥运会祥云火炬将中国传统文化、奥
(10分)⑴北京奥运会祥云火炬将中国传统文化、奥
运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
① 右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
⑵盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
29、(11分)如下图所示,烧杯中都盛有稀硫酸。
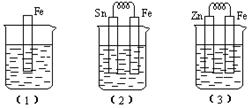
(1)中反应的离子方程式为 ,
(2)中的电极反应:Fe: 、Sn:
(3)中被腐蚀的金属是 、其电极反应式为 。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 。
28、(9分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
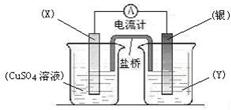 (1)电极X的材料是________;电解质溶液Y是___________;
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的____极,发生的电极反应___ ___;
X电极上发生的电极反应为
(3)当Ag+的消耗速率为0.05mol/(L·min )时,
Cu2+的生成速率为:
27、用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为
A、0.5mol·L-1 B、0.8mol·L-1 C、1.0mol·L-1 D、1.5mol·L-1
26、某研究组设想以如图所示装置用电化学原理生产硫
酸。关于该装置的叙述正确的是
A、该装置为原电池,通入O2的电极是负极
B、该装置中,通入SO2的电极的电极反应式为:
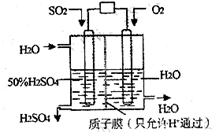 SO2-2e-+O2-+H2O=2H++SO42-
SO2-2e-+O2-+H2O=2H++SO42-
C、该装置中,H+通过质子膜向左侧移动
D、在标准状况下,理论上若通入SO2速率为2.24
L·min-1,则通入O2速率应为1.12 L·min-1
25、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
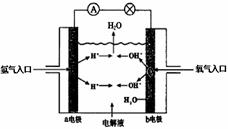 A、a电极是负极
A、a电极是负极
B、b电极的电极反应为:4OH--4e- =2H2O+O2
C、氢氧燃料电池是一种具有应用前景的绿色电源
D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部
储藏在电池内的新型发电装置
24、在体积可变的容器中发生反应N2 + 3H2  NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
A、分子运动速率加快,使反应物分子间的碰撞机会增多
B、反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C、活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D、分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
23、将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
 2HBr(g)
2HBr(g)
 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡
时Br2(g)的转化率为b。a与b的关系是
A、a>b B、a=b C、a<b D、无法确定
22、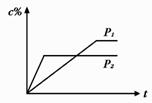 在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)  n C(g)
n C(g)
的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结
论正确的是
A、P1>P2,n<3 B、P1<P2,n>3
C、P1>P2,n>3 D、P1<P2,n<3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com