
题目列表(包括答案和解析)
3、两种物质反应,其中一种有剩余:
(1)酸与碱反应型※※ 关注所给物质的量是物质的量浓度还是pH
在审题时,要关注所给物质的量是“物质的量浓度”还是“pH”,否则会很容易判断错误
(解答此类题目时应抓住两溶液混合后剩余的弱酸或弱碱的电离程度和生成盐的水解程度的相对大小。)
[例2]: 将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A. c(HCN)<c(CN-) B. c(Na+)>c(CN-)
C. c(HCN)-c(CN-)=c(OH-) D. c(HCN)+c(CN-)=0.1mol·L-1
解析:上述溶液混合后,溶质为HCN和NaCN,由于该题已说明溶液显碱性,所以不能再按照HCN的电离处理,而应按NaCN水解为主。所以c(Na+)>c(CN-),选B D
[例3] 设氨水的pH=x,某盐酸的pH=y,已知x+y=14,且x>11。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-) B. c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C. c(NH4+)>c(Cl-)>c(OH-)>c(H+) D. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
解析:由于x+y=14,且x>11,所以氨水c(OH-) 和盐酸中的c(H+) 相等。两者等体积混合后,氨水过量,溶液显碱性,选C
[例4]等体积等浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子浓度的关系正确的是( )
A.c(M+)>c(OH-)>c(A-)>c(H+) B. c(M+)>c(A-)>c(H+)>c(OH-)
C.c(M+)>c(A-)>c(OH-)>c(H+) D. c(M+)+ c(H+) =c(A-)+ c(OH-)
分析:由于等体积等浓度的上述物质混合后,二者恰好完全反应而生成强碱弱酸盐,所以所得溶液由于A-的水解而呈碱性,由电荷守恒和物料守恒知CD项正确。
变式练习: (2004年上海卷)将标准状况下的2.24LCO2通入150ml1mol/LnaOH溶液中,下列说法正确的是(A)
A.c(HCO3-)略大于c(CO32-)
B.c(HCO3-)等于c(CO32-)
C.c(Na+)等于c(CO32-)与c(HCO3-)之和
D.c(HCO3-)略小于c(CO32-)
[解析]因为,所以生成0.05mol Na2CO3和0.05 mol NaHCO3,而CO32-水解性大于HCO3-水解性,故A项正确。
※※变式:pH等于7型
[例5].(2002年全国高考理综)常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )。
A.c(HCOO-)>c(Na+)
B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+)
D.无法确定c(HCOO-)与c(Na+)的关系
[解析]本题绝不能理解为恰好反应,因完全反应生成甲酸钠为强碱弱酸盐,溶液呈碱性,而现在Ph=7,故酸略为过量。根据溶液中电荷守恒:c(Na+)+ c(H+)= c(HCOO-)+c(OH-)
因pH=7,故c(H+)= c(OH-),所以有c(Na+)= c(HCOO-),答案为C。
※※未指明酸碱的强弱:
例:一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )
A.[A-]≥[M+] B.[A-]≤[M+]
C.若MA不水解,则[OH-]<[A-] D.若MA水解,则[OH-]>[A-]
解析:因为没有告知一元酸HA的相对强弱,因此要考虑两种情况,若是强酸,则[A-]=[M+] ,若是弱酸则 [A-]<[M+] ,还要考虑MA的水解,所以选B C
(2)盐与碱(酸)反应型(解答此类题目时应抓住两溶液混合后生成的弱酸或弱碱的电离程度和剩余盐的水解程度的相对大小。)
[例1]. (2001年上海高考题)将0.1mol·L-1 醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关粒子浓度关系正确的是( )。
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B.c(CH3COO-)>c(Cl-)+c(CH3COOH)>c(H+)
C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
[解析]两溶液混合反应后,溶液实质上是生成等浓度醋酸和醋酸钠、氯化钠的混合溶液。因溶液呈酸性说明CH3COO-的水解程度小于CH3COOH的电离程度,所以c(CH3COO-)>c(Cl-)>c(CH3COOH),但CH3COOH电离程度较小,c(CH3COOH)>c(H+),故选项A、C错误,B正确。依据电荷守恒原则,可知选项D也正确。综合上述答案选B、D。
[例2] 下列混合溶液中,各离子浓度的大小顺序正确的是
A 10mL0.1mol·L-1氨水与10mL0.1mol·L-1盐酸混合:
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10mL0.1mol·L-1NH4Cl与5mL0.2mol·L-1NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
解析:A项中氨水与盐酸混合恰好反应生成氯化铵,所以溶液显酸性,A错。B项中NH4Cl与NaOH溶液混合恰好反应生成NH3·H2O和NaCl,溶液显碱性,B正确。C项混合后溶液中溶质为CH3COONa,CH3COO-要水解,C错。D项混合后溶质为CH3COOH 、HCl 、NaCl,溶液现酸性,D错。
[例3] 物质的量浓度相同的200mL Ba(OH)2溶液和150mL NaHCO3混合后,最终溶液中离子的物质的量浓度关系正确的是
A. c(OH-)>c(Ba2+)>c(Na+)>c(CO32-) B. c(OH-)>c(Na+)>c(Ba2+)>C(H+)
C. c(OH-)=c(Ba2+)+c(Na+)+c(H+) D. c(H+)+c(Na+)+2c(Ba2+)=c(OH-)
解析:为了便于计算,设 Ba(OH)2和 NaHCO3的物质的量分别为4mol和3mol,则n(OH-)=8mol n(Ba2+)=4mol n(Na+)=3mol n(HCO3-)=3mol ;反应后.n(OH-)=5mol n(Ba2+)=1mol n(Na+)=3mol ,所以选B
2、两种物质恰好完全反应
[例](2003年上海高考题)在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度HAc溶液,反应后溶液中各微粒的浓度关系错误的是( )。
A.c(Na+)>c(Ac-)>c(H+)>c(OH-)
B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAC)
D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
[解析]由于混合的NaOH与HAc物质的量都为1×10-3mol,两者恰好反应生成NaAc,等同于单一溶质,故与题型①方法相同。由于少量Ac-发生水解:Ac- + H2O HAc+ OH-
HAc+ OH-
故有c(Na+)>c(Ac-)>c(OH-)>c(H+),根据物料守恒C正确,根据电荷守恒D正确,A错误。故该题选项为A。
※※关注混合后溶液的酸碱性
混合后溶液的酸碱性取决于溶质的电离和水解的情况,一般判断原则是:若溶液中有酸或碱存在,要考虑酸和碱的电离,即溶液相应地显酸性或碱性;若溶液中的溶质仅为盐,则考虑盐水解情况;对于特殊情景要按所给的知识情景进行判断。
1、两种物质混合不反应:
[例]:用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-) B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L
C.C(CH3COOH)>C(CH3COO-) D.C(CH3COO-)+C(OH-)=0.2 mol/L
[点拨] CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知C(CH3COO-)>C(Na+),根据电荷守恒C(CH3COO-)+C(OH-)=C(Na+)+C(H+),可得出C(OH-)<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。
5.强碱弱酸的酸式盐溶液:
[例5](2004年江苏卷)草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是(CD)
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B.c(HC2O4-)+ c(C2O42-)=0.1mol/L
C.c(C2O42-)>c(H2C2O4)
D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)
[解析]因为草酸氢钾呈酸性,所以HC2O4-电离程度大于水解程度,故c(C2O42-)>c(H2C2O4)。又依据物料平衡,所以D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)正确,又根据电荷守恒,c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),所以。综合上述,C、D正确。
4.强碱弱酸盐溶液:
[例4]在Na2S溶液中下列关系不正确的是
A. c(Na+) =2c(HS-) +2c(S2-) +c(H2S)
B.c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.c(Na+)>c(S2-)>c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+c(H2S)
解析:电荷守恒:c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-);
物料守恒:c(Na+) =2c(HS-) +2c(S2-) +2c(H2S);
质子守恒:c(OH-)=c(HS-)+c(H+)+2c(H2S),选A D
3.强酸弱碱盐溶液:
[例3]在氯化铵溶液中,下列关系正确的是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) H4+)>c(Cl-)>c(H+)>c(OH-)
H4+)=c(Cl-)>c(H+)=c(OH-) D.c(Cl-)=c(NH4+)>c(H+)>c(OH-)
分析:由于氯化铵溶液中存在下列电离过程:NH4Cl=NH4++Cl-,H2O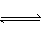 H++OH-和水解过程:NH4++H2O
H++OH-和水解过程:NH4++H2O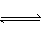 H++NH3·H2O,由于铵离子水解被消耗,所以c(Cl-)>c(NH4+),又因水解后溶液显酸性,所以c(H+)>c(OH-),且水解是微量的,所以上述关系式正确的是A项。(注意:解答这类题目时主要抓住弱碱阳离子的水解,且水解是微量的,水解后溶液呈酸性。)
H++NH3·H2O,由于铵离子水解被消耗,所以c(Cl-)>c(NH4+),又因水解后溶液显酸性,所以c(H+)>c(OH-),且水解是微量的,所以上述关系式正确的是A项。(注意:解答这类题目时主要抓住弱碱阳离子的水解,且水解是微量的,水解后溶液呈酸性。)
2.弱碱溶液:
[例2]室温下,0.1mol/L的氨水溶液中,下列关系式中不正确的是( )
A. c(OH-)>c(H+) H3·H2O)+c(NH4+)=0.1mol/L
H4+)>c(NH3·H2O)>c(OH-)>c(H+) D.c(OH-)=c(NH4+)+c(H+)
分析:由于氨水溶液中存在一水合氨的电离平衡和水的电离平衡,所以所得溶液呈碱性,根据电荷守恒和物料守恒知BD正确,而一水合氨的电离是微量的,所以C项错误,即答案为C项。
1.弱酸溶液:
[例1]在0.1mol/L的H2S溶液中,下列关系错误的是( )
A.c(H+)=c(HS-)+c(S2-)+c(OH-) B.c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(H+)>[c(HS-)+c(S2-)+c(OH-)] D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L
分析:由于H2S溶液中存在下列平衡:H2S 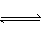 H++HS-,HS-
H++HS-,HS-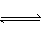 H++S2-,H2O
H++S2-,H2O H++OH-,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),由物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1mol/L,所以关系式错误的是A项。(注意:解答这类题目主要抓住弱酸的电离平衡。)
H++OH-,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),由物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1mol/L,所以关系式错误的是A项。(注意:解答这类题目主要抓住弱酸的电离平衡。)
3、分清他们的主要地位和次要地位
[常见题型]
2、掌握解此类题的三个思维基点:电离、水解和守恒
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com