
题目列表(包括答案和解析)
1.在物质结构研究的历史上,首先提出“化学原子论”,认为“原子是化学元素的最小粒子,每一种元素有一种原子”的科学家是 ( )
A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔
2. ΔH=-207.8kJ. mol-1,ΔS=-753.3J. mol-1. K-1,ΔH –TΔS=17.861kJ. mol-1
1. 反应在常温下能自发进行,同时反应的转折温度较高,为2122K,因此是可行的。
11.291.7K 12.ΔS=-274.5J. mol-1. K-1,150℃时ΔH –TΔS=-790.24kJ. mol-1,能自发进行。
拓展提高
10.(1)ΔH=-261.11 kJ. mol-1,ΔS=129.27J. mol-1. K-1,ΔH –TΔS=-299.65kJ. mol-1,能自发进行;
(2)ΔH=-173.09kJ. mol-1,ΔS=366.89J. mol-1. K-1,ΔH –TΔS=-356.54kJ. mol-1,能自发进行。
9.(1)ΔH=92.38 kJ. mol-1,ΔS=198.26J. mol-1. K-1,ΔH –TΔS=33.3kJ. mol-1,不能自发进行;
(2)T>466 K
7.C,B,77,A,-161.6,D 8.3,4,1,2
1.D 2.A 3.A 4.D 5.C 6.负,岐化,正,CO,CO2
2.在298 K时,下列反应的ΔH依次为:
C8H18(g)
+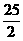 O2(g)→8 CO2(g)
+ 9H2O(l);△H1 = -5512.4 kJ. mol-1
O2(g)→8 CO2(g)
+ 9H2O(l);△H1 = -5512.4 kJ. mol-1
C(石墨) + O2(g) → CO2(g); △H2 = -393.5 kJ. mol-1
H2(g)
+ 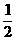 O2(g) →H2O(l);
△H3
= -285.8kJ. mol-1
O2(g) →H2O(l);
△H3
= -285.8kJ. mol-1
正辛烷(C8H18)、氢气和石墨的熵值分别为:463.7、130.6、5.694 J. mol-1. K-1。则298 K时,由单质生成1 mol正辛烷的ΔH、ΔS及ΔH-TΔS分别为多少?
w。w-w*k&s%5¥u
第1节 化学反应的方向
基础训练
1.已知下列数据:
|
|
CaSO4(s) |
CaO(s) |
SO3(g) |
|
Δf H/ kJ. mol-1 |
-1432.7 |
-635.1 |
-395.72 |
|
S/ J. mol-1. K-1 |
107.0 |
39.75 |
256.65 |
通过计算说明能否用CaO(s)吸收高炉废弃中的SO3气体以防止SO3污染环境。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com