
题目列表(包括答案和解析)
25.(14分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。⑴冶炼铜的反应为*k*s*5*u*
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2: S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。 、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
24.(12分)下图是工业生产硝酸铵的流程。
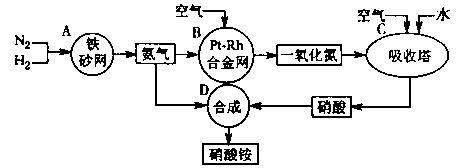
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化
还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)
 2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率
为 。
23.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH、Fe2+、SO和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO
D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH
22.下列说法正确的是
A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐*k*s*5*u*
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用标准盐酸滴定待测NaOH溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
21. 某钠盐溶液中可能含有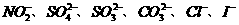 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中含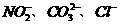 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A. ①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
20.下列实验操作与预期实验目的或所得实验结论一致的是
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是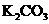 |
|
B |
向含有少量 的 的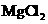 溶液中加入足量 溶液中加入足量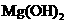 粉末,搅拌一段时间后过滤 粉末,搅拌一段时间后过滤 |
除去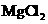 溶液中少量 溶液中少量 |
|
C |
常温下,向饱和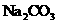 溶液中加少量 溶液中加少量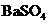 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下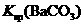 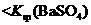 |
|
D |
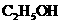 与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性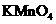 溶液 溶液 |
检验制得气体是否为乙烯 |
19. 下列关于实验原理或操作的叙述中,不正确的是:
A. 从碘水中提取单质碘时,不能用无水乙醇代替CCl4
B. 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
C. 纸层析实验中,须将滤纸上的试样点浸入展开剂中
D. 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
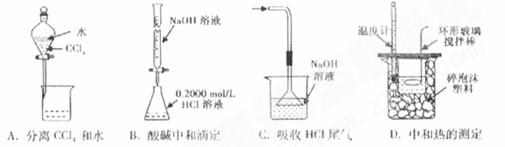
18.下列实验装置(固定装置略去)和操作正确的是*k*s*5*u*
17.除去下列括号内杂质的试剂或方法错误的是
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤 B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶 D.C2H5OH(CH3COOH),加足量CaO,蒸馏
16.下列实验操作都能够达到预期目的的是
①蒸干AlCl3溶液可得纯净的无水氯化铝学②可以采用多次盐析或多次渗析的方法分离、提纯蛋白质③用广泛pH试纸测得某溶液pH为3.5④滴入酚酞溶液确定纯碱中有无烧碱 ⑤用K3[Fe(CN)6](铁氰化钾)检验亚铁离子⑥用酸式滴定管量取20.00mL高锰酸钾酸性溶液
A.①②⑤⑥ B. ②③⑤⑥ C.②⑤⑥ D.全部
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com