
题目列表(包括答案和解析)
1.B 2.C 3.负极,CH4 –8e– +10OH– == CO32– + 7H2O 4.正极:O2 + 2CO2 +4e– == 2 CO32–;负极:2CO +2 CO32– -4e– ==4CO2
总方程式:2CO + O2
== 2CO2 5.略 6.(1)正(2)2NaCl+2H2O H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
(3)Zn-2e=Zn2+ , Zn2++2e=Zn,ZnSO4溶液或ZnCl2溶液
1.D 2.B 3.A 4.C 5.B 6.A 7.A 8.D 9.B 10.B 11.A 12.C 13.AC14.略15. 2H+ +2e-- == H2↑;Cu2+ + 2e– == Cu ;2H+ +2e– == H2↑;D〉A〉B〉C 16.略
拓展提高
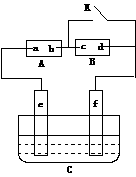
6. 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,
接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为______________极
(2)滤纸B上发生的总化学方程式为:________________________________
欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:
__________________________,电极f上发生的反应为:_____________________,
槽中盛放的镀液可以是_________________或_________________(只要求填两种电解质溶液)。
科学前沿
新能源---可燃冰
“冰”怎么会“可燃”?即使是二氧化碳在超低温状态下形成的“干冰”也不可燃。但确有“可燃冰”存在,它是甲烷类天然气被包进水分子中,在海底低温与压力下形成的一种类似冰的透明结晶。据专家介绍,1立方米“可燃冰”释放出的能量相当于164立方米的天然气。目前国际科技界公认的全球“可燃冰”总能量,是所有煤、石油、天然气总和的2-3倍。美国和日本最早在各自海域发现了它。我国近年来也开始对其进行研究。
“可燃冰”的主要成分是甲烷与水分子(CH4·H2O)。它的形成与海底石油、天然气的形成过程相仿,而且密切相关。埋于海底地层深处的大量有机质在缺氧环境中,厌气性细菌把有机质分解,最后形成石油和天然气(石油气)。其中许多天然气又被包进水分子中,在海底的低温与压力下又形成“可燃冰”。这是因为天然气有个特殊性能,它和水可以在温度2-5摄氏度内结晶,这个结晶就是“可燃冰”。
有天然气的地方不一定都有“可燃冰”,因为形成“可燃冰”除了压力主要还在于低温,所以一般在冰土带的地方较多。长期以来,有人认为我国的海域纬度较低,不可能存在“可燃冰”;而实际上我国东海、南海都具备生成条件。
东海底下有个东海盆地,面积达25万平方公里。经20年勘测,该盆地已获得1484亿立方米天然气探明加控制储量。尔后,中国工程院院士、海洋专家金翔龙带领的课题组根据天然气水化物存在的必备条件,在东海找出了“可燃冰”存在的温度和压力范围,并根据地温梯度、结合东海地质条件,勾画出“可燃冰”的分布区域,计算出它的稳定带的厚度,对资源量做了初步评估,得出“蕴藏量很可观”结论。这为周边地区在新世纪使用高效新能源开辟了更广阔的前景。
世界第一艘燃料电池潜艇U-31
2003年4月7日,德国基尔港升起了一颗世界级的明星。它是一艘奇特的潜艇,名字叫U31。国际主要媒体都往它这儿聚焦,庆贺世界第一艘燃料电池潜艇下水及首次试航。全德国的人都为U31自豪,因为它闯开了常规潜艇的一条发展新路,成为世界潜艇发展史上的一个新里程碑;到2004年春服役后,它就是“世界范围内最先进的常规动力潜艇”。 传统的柴-电动力潜艇在水下潜航2-3天,就会耗尽电池能量,必须浮上水面给蓄电池充电。显然,这增加了潜艇暴露的危险性。而U31就没有这种烦恼,因为它在水下就能自行充电,取得了“不依赖空气”的技术突破。突破出在动力舱。它采用性能优越的混合动力系统,即燃料电池动力系统和柴-电动力系统混合使用。但奇迹主要出在燃料电池动力系统。这个系统由9组聚四氟乙烯燃料电池、14吨液氧贮存柜和1.7吨气态氢贮存柜等3部分组成。它的燃料电池尺寸小,无腐蚀,功率密度大,使用寿命长。热交换器、排出泵、冷却水泵、催化剂罐、燃料电池电子设备、斩波器和逆变器等是燃料电池的主要部分。它不用空气,而是将氢燃料和氧化物放到特殊燃烧室内进行电化学反应,直接转换成电能,输出的直流电直接驱动电动机,电动机带动桨轴,推进潜艇航行。每组燃料电池的输出功率为34千瓦,9组总功率306千瓦。用燃料电池提供的动力驱动,U31可在水下连续潜行3周。
铝的冶炼史
传说拿破仑三世的刀叉具是用铝制造的。筵席上,他为多数客人提供金餐具,而只让少数客人使用铝餐具,是为了让用铝餐具的客人留下更深刻印象。
1885年,在美国首都华盛顿特区落成的华盛顿纪念碑上的顶帽也是用金属铝制造的。因为在19世纪,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金相当。因为从铝矿石中把铝提炼出来,是极其困难的。1825年,丹麦的奥斯特分离出少量的纯铝。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了铝。但是钾太昂贵了,所以不允许大规模地生产。又过了27年,法国化学家德维尔用金属钠与无水氯化铝一起加热而获得闪耀金属光泽的小铝球。改用金属钠虽然极大地降低了铝的生产费用,但显然没有达到能使人们普遍应用铝的程度。
1884年,在美国奥伯林学院化学系,有一位叫做查尔斯·马丁·霍尔的青年学生。当时他只有二十一岁。一次,他听一位教授(这位教授正是维勒的学生)说:“不管谁能发明一种低成本的炼铝法,都会出人头地。”这使霍尔意识到只有探索廉价的炼铝方法,才能使铝被普遍应用。霍尔决定在自己家里的柴房中办一个家庭实验室。他打算应用戴维早期的一项发明:把电流通到熔融的金属盐中,可以使金属的离子在阴极上沉积下来,从而使金属离子分离出来。因为氧化铝的熔点很高(2050℃),他必须物色一种能够溶解氧化铝而又能降低其熔点的材料,偶然发现了冰晶石(Na3AlF6)。冰晶石一氧化铝熔盐的熔点仅在930℃-1000℃之间,冰晶石在电解温度下不被分解,并有足够的流动性。这样就有利于电解的进行。霍尔采用瓷坩埚,碳棒(阳极)和自制电池,对氧化铝,即精制的氧化铝矿进行电解。把氧化铝溶在10%-15%的熔融的冰晶石里,再通以电流,结果观察到有气泡出现,然而却没有金属铝析出。他推测,电流使坩埚中的二氧化硅分解了,因此游离出硅。于是他对电池进行改装,用碳作坩埚衬里,又将碳作为阴极,从而解决了这一难题。1886年2月的一天,他终于看到小球状的铝聚集在阴极上。霍尔此时异常激动,带着他第一次获得的一把金属铝球去见他的教授。后来,这些铝球竟成为“王冠宝石”,至今仍珍存在美国制铝公司的陈列厅中。廉价炼铝方法的发明,使铝这种在地壳中含量占8%的元素,从此成了为人类提供多方面重要用途的材料。而发明家霍尔,当时还不满23周岁,这年12月6日才是他的23岁生日。
还有一件值得提及的事,非常巧合,一位与霍尔同龄的年轻的法国化学家埃鲁也在这年稍晚些时候发明了相同的炼铝法。霍尔与埃鲁在遥远的两大洲,同年来到人世(1863年)又同年发明了电解炼铝法(1886年)。虽然他们之间曾一度发生了专利权的纠纷,但后来却成为莫逆之交。1911年,当美国化学工业协会授予霍尔著名的佩琴奖章时,埃鲁还特意远涉重洋到美国参加了授奖仪式,亲自向霍尔表示祝贺。或许是上天的旨意,1914年,这两位科学家又都相继去世。难怪当后人们一提起电解炼铝法的时候,便总把霍尔和埃鲁的名字联在一起。
w。w-w*k&s%5¥u
第3节 化学能转化为电能------电池
基础训练
5.有一位喜欢追赶时髦的富翁决定建一艘海上游艇,为了使游艇奢侈豪华,他不惜重金让造船师用昂贵、漂亮、对海水有很强抗腐蚀能力的镍铜合金将船底包起来。由于这种镍铜合金的机械强度不够大,于是造船师不得不用特种的钢来制造游艇的许多零件,在一片赞美声中,游艇徐徐下水,畅游于碧海波涛之中,可是时间不长,这艘游艇的底部千疮百孔,过早地结束了生命。你知道这是为什么吗?
答:______________________________________________________________________。
4.熔融盐燃料电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的.熔融盐混合物做电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池。完成上述有关的电池反应式:
正极反应式:____________________________________________
负极反应式:____________________________________________
总电池反应式:__________________________________________
3.将铂丝插入KOH溶液做电极,然后向两个电极上分别通入甲烷和氧气,可以形成原电池,由于发生的反应类似于甲烷的燃烧,所以称做燃料电池,根据两极上反应的实质判断,通入甲烷的一极为电池的____极,这一极的电极反应式为__________________.
2.已知电解饱和食盐水可制得Cl2,又已知铅蓄电池放电时发生如下反应:
正极:PbO2 + 4H+ +SO42– +2e-- ==PbSO4 + 2H2O
负极:Pb + SO42– +2e-- == PbSO4
现拟用铅蓄电池做电源电解饱和食盐水制氯气0.05mol,电池内H2SO4的消耗量至少是( )
A.0.025mol B.0.05mol C.0.10mol D.0.20mol
1.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%--40%的KOH溶液的多孔碳电极,其电极反应式为:2H2 + 4OH– - 4e– == 4H2O和O2 +2H2O+4e– == 4OH–则下列叙述正确的是( )
A. 通H2的一极是正极,通O2的一极是负极
B. 通O2的一极是正极,通H2的一极是负极
C. 工作一段时间后电解质溶液的pH增大
D. 工作时负极区附近pH增大
16.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:
2FeCl3 + Cu == 2 FeCl2 + 2CuCl2
(1)画出装置图:
(2)电极材料和电解质溶液各是什么?
(3)写出电极反应式
拓展提高
15.由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表
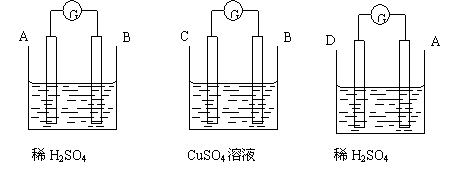
装
置
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com