
题目列表(包括答案和解析)
2.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br -
C.Mg2+、Cl-、I- D.Na+、NH4+、Cl-
1. 在做中和热的测定实验中,使用下列用品不是为了减小实验误差的是
A两个量筒 B.环形玻璃搅拌棒 C.用保温杯代替烧杯 D.碎泡沫塑料
27、(10分)如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计的实验方案如下
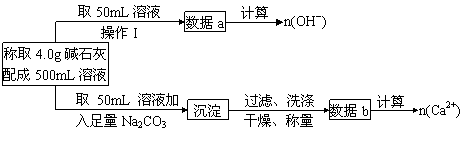

①下列关于溶液中n(Na+)的计算式中正确的是________。(填序号)
a.n(Na+) = n(OH-) - 2n(Ca2+) b.n(Na+) = [n(OH-)- n(Ca2+)]/2
c.n(Na+) = 2n(OH-)- n(Ca2+)
②现有4.0g碱石灰,设其中n(OH-)=x mol,n(Ca2+)=y mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH,CaO |
NaOH,CaO , Ca(OH)2 |
NaOH,Ca(OH)2 |
NaOH, Ca(OH)2,H2O |
|
x、y之间关系式(等式或不等式) |
|
40x-24y<4.0<40x-6y |
|
|
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,氢氧化钠在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g 。请通过计算确定该碱石灰各成分的质量分数。

|
|||||||||||
 |
|||||||||||
|
|||||||||||
|
|||||||||||
|
|||||||||||
|


2007届江苏省西亭高级中学高三化学10月份综合训练
26、(8分)有硫酸钠和碳酸镁的混合物,用40mL 盐酸完全溶解后,在标准状况下收集到0.448L二氧化碳。向反应后的溶液中加入含有0.025mol氢氧化钡的溶液,可得到5.82g沉淀,此时溶液的pH=12,体积为200mL。试求:
(1)原混合物中MgCO3的质量
(2)得到的沉淀中硫酸钡的质量
(3)盐酸的物质的量浓度
25.(8分)化合物A由C、H、O、N 4种元素组成,M<300,其中ω(N)=4.81%,
m(C)∶m(O)=3∶1。A在酸性溶液中水解生成B和C。
回答下列问题: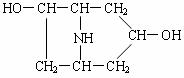
⑴ A的分子式为 ;
⑵ 若B的结构如右图所示,C分子中有一个甲基,是芳香族化合物,其苯环上只有1个取代基。1molC能与2molNa反应生成1molH2,但1molC只能中和1molNaOH。则A可能的结构有2种,请写出其中1种 ;
⑶ 物质C有多种同分异构体,请按要求写出其中两种:
① 能使FeCl3溶液显色,也能使紫色石蕊试液显红色;分子内有1个乙基,苯环上取代基均处于间位: ;
② 既能发生水解反应,又能发生银镜反应;不能使FeCl3溶液显色,但能和Na反应生成H2,分子内无甲基且苯环上的一氯取代物有2种: 。
24.(4分)某有机物含有C、H、O、N四种元素,下图为该有机物的球棍模型。
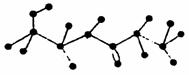 (1)该有机物的结构简式为________________。
(1)该有机物的结构简式为________________。
(2)该有机物不可能发生的化学反应有________
(填序号)。
①水解 ②加聚 ③取代
④消去 ⑤酯化 ⑥缩聚
23.“室内空气污染”是影响人们身体健康的重要原因。造成室内空气污染的有毒物质主要有甲醛、苯、氨、氡四种。甲醛主要存在于人造板材、复合地板、涂料中;苯是直接致癌物,污染源主要有油气、胶、内墙涂料、防水材料;氨主要是存在于混凝土墙体、防冻液中;用来染发的物质都含有大量的氨。氡是自然界唯一的天然放射性稀有气体,无色无味,最难以察觉。氡是导致人类除吸烟以外引起肺癌的第二大因素,世界卫生组织(WHO)把它列为使人致癌的19种物质之一,洁具、石材多含有氡。回答下列问题:
⑴ 小陈同学家刚买了一套新房并进行了装修。在小陈同学家搬进新居前,出于对小陈同学健康的关心,请你对小陈同学提两点建议: , ;
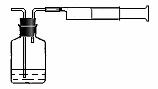 ⑵我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg·m-3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
⑵我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg·m-3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
① 如果你帮助小陈同学检查该装置的气密性,你操作的方法是 ;
② 请你帮助小陈同学选择装置中试剂瓶内的药品: (填序号);
a.稀银氨溶液 b.稀酸性高锰酸钾溶液 c.新制得氢氧化铜悬浊液
③ 在检查好装置气密性和选择好试剂瓶内的药品后,请你帮助小陈同学完成该实验的操作 ;
④ 若试剂瓶内溶液的体积和浓度已知,注射器容积为100 mL,实验时还需知道的数据有 ,为了保证数据的科学性,还需注意的问题是 。
22.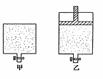 (6分) 有甲、乙两个密闭容器,如图所示,甲容器能保持容积恒定,乙容器能保持压强恒定:
(6分) 有甲、乙两个密闭容器,如图所示,甲容器能保持容积恒定,乙容器能保持压强恒定:
(1)在甲容器中加入2mol三氧化硫和1mol N2,乙容器中加入2mol二氧化硫和1mol氧气,起始时容积相同,在相同的温度下(500℃)反应均达平衡。则两容器内压强甲________乙,(填大于、小于或等于,下同);容器内混合气体的平均相对分子质量甲______乙。
(2)若在两个容器中,甲中加入2mol三氧化硫,乙中加入4mol三氧化硫,起始时两容器内的温度和压强均相同,反应过程中,温度保持一定。若达平衡后,甲容器内三氧化硫的物质的量为a mol,则乙容器中三氧化硫的物质的量__________2a mol。(填,大于、小于或等于)。
21.(9分)某待测液中的阳离子可能含有K+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、Mg2+等。进行下述实验(所加试剂均过量):

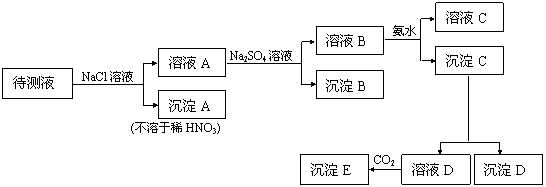

根据实验结果,填写下列空白:
⑴ 能确定存在的阳离子有 ,可能存在的阴离子有 ;
⑵ 若要证明K+的存在,还需进行的试验是 ;
⑶ 若要说明Mg2+存在,必须说明的现象是 ;
⑷ 从溶液D生成沉淀E的离子方程式是 。
20.(8分)已知X、Y、Z、W均为短周期元素,其原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子中共有10个电子;Z单质在通常状况下为无色无味气体;W原子的最外层电子数是核外电子总数的3/4。试回答:
(1)由X、Z、W三种元素可组成一种盐,该盐是常用的速效化肥,不宜与碱性肥料混合或在碱性土壤中施用,其原因是_________________________________。
(2)由X、Y、Z、W四种元素可组成多种化合物,其中既能与盐酸又能与烧碱溶液反应的无机物是______________,有机物是___________________(各写一种)。
(3)将1.2 gY单质在足量W单质中燃烧所得的气体通入150 mL 1mol·L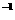 NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com