
32.(8分)[化学--物质结构与性质]
A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素基态原子的最外层电子排布为nsnnpn,B的氢化物可与它的最高价氧化物的水化物反应生产盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素基态原子的核外电子排布式是 。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是 。(填氢化物的分子式)。
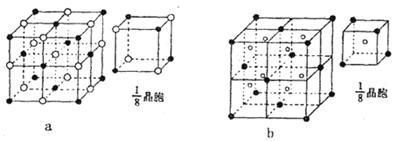
(3)B与E可形成离子化合物BE5、BE5的电子式是 。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物结构是 ________________ (填字母标号a或b)
31.(8分)[化学--化学与技术]
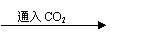
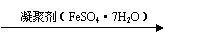
 以下是自来水厂处理源水的工艺流程示意图:
以下是自来水厂处理源水的工艺流程示意图:
 源水
暴气池
一级沉降池
二组级沉降池
过滤池→自来水
源水
暴气池
一级沉降池
二组级沉降池
过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、C1-等,加入生石灰,生成Ca(OH)2溶液,进而发生若干复分解反应,写出其中一个反应的离子方程式 。
(2)凝聚剂在水中生成 Fe(OH)3胶粒,凝聚剂除去悬浮固体颗粒的过程 。
A.只是物理过程 B.只是化学过程 C.既有物理过程,也有化学过程
(3)通过CO2的目的
。
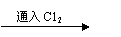
(4)C12具有杀菌作用,其原因是 。
30.(14分)科学的发展有一个不断深化的过程。人们对有机化合物的认识同样是这样。
(1)1828年,德国化学家武勒(F·WOhler)冲破了生命力学说的束缚,在实验室里将无机物氰酸铵(NH4CNO)溶液蒸发,得到了有机物尿素[CO(NH2)2]。
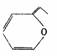
互为同分异构体的是
 (2)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,
(2)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,
它不能解释下列 事实
(填入编号)
a.苯不能使溴水褪色
b.苯能与H2 发生加成反应
c.溴苯没有同分异构体
d.邻二溴苯只有一种
将苯与浓硫酸和硝酸混合共热并保存50℃-60℃的温度,可以生成硝基苯。反应后的仪器中有硝基苯、苯和残酸,为得到纯净的硝基苯,要进行中和、水洗,其目的是 ;已知苯的沸点是80℃,硝基苯的沸点是210.9℃,将苯与基苯分离开的实验操作是 。
(3)糖类又称碳水化合物,这是因为过去发现的糖类太多可以用通式Cn(H2O)m来表示。实际上很多符合通式为Cn(H2O)m的化合物并不属于糖类,写出两种符合通式Cn(H2O)m而不属于糖类的有机化合物的结构简式 。
(4)1830年,德国化学家李比希发展了碳、氢分析法,为有机化合物的定量分析打下了基础。某含C、H、O三种元素的未知物,经燃烧实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%,则A的分子式为 。
A为有关物质存在如下转化关系,B是当今世界产量最大的塑料,广泛用于食品、医药、衣物、化肥等的包装。

写出下列反应化学方程式
①
。
② 。
|
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(15分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
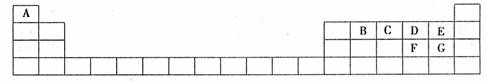
(1)B和F的最高价氧化物对应的水化物中酸性较强的是 (填经学式),写出可以验证该结论的一个离子方程式 。
(2)AE的水溶液可用于刻蚀玻璃,反应的化学方程式为 。
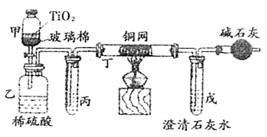 (3)小型电镀厂排出的污水中含有剧毒的BC-,可用右图所示装置所理浓缩后的污水(200mL,BC-的浓度为0.05ml·L-1),并测定BC-被处理的百分率。仪器甲中TiO2是催化剂,发生的反应是用过量的NaC1O将BC-氧化成BCD-;甲中反应后的溶液放入乙中,在酸性条件下BCD-继续被NaC1O氧化成C2和BD2
(3)小型电镀厂排出的污水中含有剧毒的BC-,可用右图所示装置所理浓缩后的污水(200mL,BC-的浓度为0.05ml·L-1),并测定BC-被处理的百分率。仪器甲中TiO2是催化剂,发生的反应是用过量的NaC1O将BC-氧化成BCD-;甲中反应后的溶液放入乙中,在酸性条件下BCD-继续被NaC1O氧化成C2和BD2
回答下列问题:
①乙中反应的离子方程式为
。
②乙中生成的气体除C2和BD2外,还有HC1及副产物C12等,上述实验是通过测定BD2的量来确定BC-的处理效果。则丙中加入的试剂是 ,丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
③戊中盛有过量的澄清石灰水,若实验结束后戊中共生成沉淀0.82g,则该实验中测得BC-被处理的百分率为 。
④某同学对上述实验进行全面的分析后,得出测定结果比实际结果偏低的结论。你认为此结论 (填“正确”或“不正确”)
28.(13分)短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
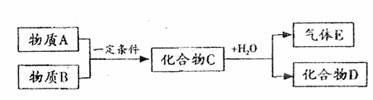
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物。
①用电离方程式解释C既能溶于强酸,又能溶于强碱的原因。
。
②用等式表示E与NaOH溶液反应后的溶液中所有离子浓度之间的关系
。
(3)若C是一种气体,D是一种强酸,则:
 ①C与水反应的化学方程式为
。
①C与水反应的化学方程式为
。
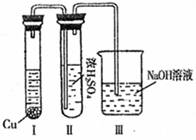
②有人认为“浓H2SO4可以干燥气体C”。
某同学为了验证该观点是否正确,用右图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是 。
③已知常温下物质A与物质B生成1mol气体C的焓变为-57.07kJ, 1 mol气体C与H2O反应生成D溶液和E气体的焓变为-46kJ,写出物质A与物质B及水生成D溶液的热化学方程式 。
15. 以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自身离解:SO2(1)+SO1(1) SO32-+SO2+,以液态SO2为溶剂,用SOC12的液态SO2溶液滴定Cs2SO3的液态SO2溶液。下列有关叙述错误的是
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自身离解:SO2(1)+SO1(1) SO32-+SO2+,以液态SO2为溶剂,用SOC12的液态SO2溶液滴定Cs2SO3的液态SO2溶液。下列有关叙述错误的是
A.液态SO2自身离解的存在,说明SO2是离子化合物
B.该滴定反应原理可表示为:SO32-+SO2+=2SO2
C.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
D.SOC12和Cs2SO3均能抑制SO2的自身离解
|
[必做部分]
14.如下图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:
 2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度,下列说法不正确的是
2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度,下列说法不正确的是
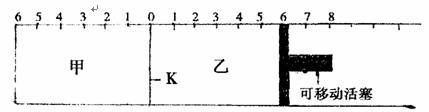
A.根据隔板K是否滑动可判断左右两边的反应是否达到平衡
B.达到平衡后,隔板K最终停留在左侧刻度0-2之间
C.达到平衡后,甲容器中C的物质的量大于乙容器中C的物质的量
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
13.2005年10月12日,我国“神舟”六号载人飞船成功发射。航天飞船可用铝粉与高氯酸铵的混合物做固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应:
2NH4C1O4=N2↑+4H2O+C12↑+2O2↑。下列反应的叙述不正确的是
A.NH4C1O4晶体中既有离子键又有共价键
B.该反应主要是化学能转化为热能
C.NH4C1O4易溶于水,水解显碱性
D.每有1molNH4C1O4分解,就有7mol电子转移
12.下列离子方程式书写正确的是
A.铁和稀硫酸反应 2Fe+6H+=2Fe3++3H2↑
B.氢氧化钡和稀硫酸中和 SO42-+Ba2++H++OH-=H2O+BaSO4↓
C.向Ca(OH)2溶液中通入少量CO2气体 Ca2++CO2+2OH-=CaCO3↓+H2O
 D.NaHCO3水解 HCO3-+H2O H3O+CO32-
D.NaHCO3水解 HCO3-+H2O H3O+CO32-
11.NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1.8g的NH4+中含有质子数为NA
B.常温常压下,48gO3含有的原子数为3NA
C.常温常压下,11.2L氧气所含原子数为NA
D.2.7g金属铝变为铝离子时失去的电子数为0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com