
1.下列各类反应中,全部是氧化还原反应的是 ( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
24.实验室用需配制230mL 0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制230 mL 0.1mol/L的Na2CO3溶液
|
实际应称Na2CO3质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
|
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ___ _____;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的Na2CO3的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为____ ______________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
①若没有进行A操作 ;
②若加蒸馏水时不慎超过了刻度 ;
③若定容时俯视刻度线___________________
23.某学生设计了如图所示的实验方案,从NaCl、CaCl2的固体混合物中分离出NaCl和CaCl2。
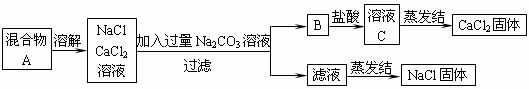
回答下列问题:
(1)B物质的名称是 。
(2)将此实验分离得到的NaCl,经分析含杂质是因为上述方法中某一步设计的错误,请写出错误的这一步正确的设计方案:
(3)若实验结束时,称量得到的NaCl固体的质量为17.55g,CaCl2固体的质量为11.1g,则原混合物中NaCl和CaCl2的物质的量之比为 。
22.M(NO3)2热分解化学方程式为
:2M(NO3)2 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,则收集到的气体平均相对分子质量为
,M的摩尔质量是 。
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,则收集到的气体平均相对分子质量为
,M的摩尔质量是 。
21.l mol CO2的质量是一个CO2分子质量的 倍,l mol CO2的质量与CO2的相对分子质量相比,两者 相同,但前者以 为单位。5molCO32-是 g,它和 mol Mg2+含有相同的质量,它和 gSO42-含有相同的离子数。
20.将标准状况下的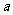 LHCl(g)溶于1000g水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是
LHCl(g)溶于1000g水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是
A.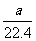 mo1·L-1 B.
mo1·L-1 B.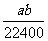 mol·L-1
mol·L-1
C.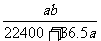 mol·L-1 D.
mol·L-1 D.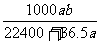 mol·L-1
mol·L-1
第Ⅱ卷(非选择题,共40分)
19.将溶质质量分数为a%,物质的量浓度为c1 mol/L的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol/L,则c1和c2的数值关系是C
A.c2=c1 B.c2<c1 C.c2>2c1 D.无法确定
18.用10 mL的0.1 mol/L BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.3∶2∶2 B.1∶2∶3 C.1∶3∶3 D.3∶1∶1
17.在标准状况下, m gA气体与n gB气体分子数相等,下列说法不正确的是
A.标准状况下,同体积的气体A和气体B的质量比m : n
B.25℃时,1 kg气体A与1 kg气体B的分子数之比为n: m
C.同温同压下,气体A与气体B的密度之比为m : n
D.标准状况下,等质量的A与B的体积比为m : n
16.某种H2和CO的混合气体,其密度是O2的一半,则氢气的体积分数为
A.40% B.46% C.50% D.54%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com