
4. 升高温度能加快反应速率的主要原因是( )
A.活化分子能量明显增加
B.降低活化分子的能量
C.增加活化分子百分数
D.降低反应所需要的能量
3.在2L密闭容器中,盛有2molX和 2molY物质进行如下反应: 2X(s)+3Y(g) Z(g),当反应进行10s后,测得生成0.5molZ,则这期间的平均反应速率为 ( )
Z(g),当反应进行10s后,测得生成0.5molZ,则这期间的平均反应速率为 ( )
A.v(Z)=0.025mol/(L·s) B.v(X)=0.025mol/(L·s)
C.v(Y)=0.05mol/(L·s) D.v(Y)=0.075mol/(L·s)
2. 100mL 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4(s) B.NaOH (s)
C.K2SO4溶液 D.(NH4)2SO4(s)
1.下列叙述正确的是 ( )
A.电能是二次能源 B.水力是二次能源
C.天然气是二次能源 D.水煤气是一次能源
32.[化学选考题](以下三题任选一题,若都答按前面一题计分)
A.[化学--选修化学与技术](15分)
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在 部分发生反应,在______
部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为 ;加入硅、锰和铝的目的是 。
(3)不锈钢含有的Cr 元素是在炼钢过程的氧吹 (填“前”或“后”)加入,原因是 。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是 。从环保和经济角度考虑,上述尾气经处理可用作 。
B.[化学--选修物质结构与性质](15分)
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为__________;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素名称是____________;
(3)D和Y形成的化合物,其分子的空间构型为____________;
(4)D 和X形成的化合物,其化学键类型属___________,其晶体类型属__________;
(5)写出E原子的电子排布式 ;
(6)试比较D和X的最高价氧化物熔点的高低并说明理由:
_______
C.[ 化学--选修有机化学基础](15分)
A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
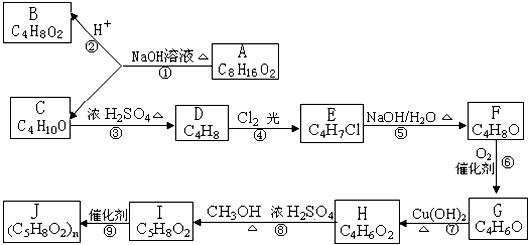
(1)B和C均为有支链的有机化合物,B的结构简式为 ;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为 。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为
(3)写出⑤的化学反应方程式 。
⑨的化学反应方程式 。
(4)①的反应类型 ,④的反应类型 ,⑦的反应类型 。
(5)与H具有相同官能团的H的同分异构体的结构简式为 。
28.(15分)
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
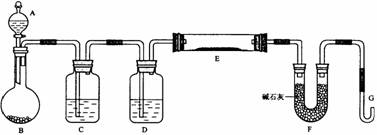
请回答下列问题。
(1)仪器中装入的试剂:B_________ 、C________、D___________;
(2)连接好装置后应首先_________________________,其方法是________________
。
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是
。在这两步之间还应进行的操作是________________________;
(4)U形管F的作用是____________________________;
(5)反应过程中G管逸出的气体是________________,其处理方法是
________________________________________________________________。
(6)从实验中测得了下列数据
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
由以上数据可以列出计算W的相对原子质量的计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式:W的相对原子质量:Ar(W)=____________________。
27.(14分)
某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”):
(1)将少许混合物放入水中得到无色溶液和白色沉淀。肯定存在的物质是 ,肯定不存在的物质是 。
(2)取溶液进行焰色反应,火焰呈黄色;肯定存在的物质是 ,肯定不存在的物质是 。
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。肯定存在的物质是 ,肯定不存在的物质是 。
(4)通过上述实验仍无法确定的物质是______________。
26.(14分)
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
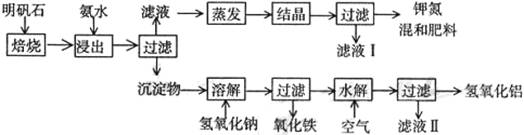
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)78mL,所用仪器除用规格为 mL量筒、玻璃棒、烧杯、胶头滴管外还有 (填仪器名称)。
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是 。
(3)写出沉淀物中所有物质的化学式 。
(4)滤液I的成分是水和 。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量BaCl2溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
(6)⑸中第②步骤中的第二个实验操作具体方法是
______________________________________________________________________。
13.在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入bmol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为 ( )
A. B. C. D.
|
12.下列现象或事实可用同一原理解释的是 ( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.氯水和二氧化硫使品红溶液褪色
C.漂白粉和亚硫酸钠长期暴露在空气中变质
D.浓硝酸和碘化银试剂储存在棕色试剂瓶中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com