
26.(10分)已知:①卤代烃在一定条件下可以和金属反应,生成烃基金属有机化合物,该有机化合物又能与含羰基(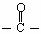 )的化合物反应生成醇,其过程可表示如下:
)的化合物反应生成醇,其过程可表示如下:
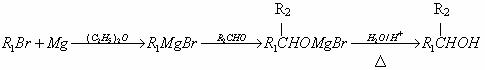
(-R1、、-R2表示烃基)
②有机酸和PCl3反应可以得到羧酸的衍生物酰卤: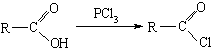
③苯在AlCl3催化下能与酰卤作用生成含羰基的化合物:
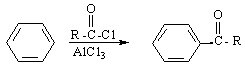
科学研究发现,有机物X、Y在医学、化工等方面具有重要的作用,其分子式均为C10H14O,都能与钠反应放出氢气,并均可经上述反应合成,但X、Y又不能从羰基化合物直接加氢还原得到。X与浓硫酸加热可得到M和M',而Y与浓硫酸加热得到N和N'。M、
N分子中含有两个甲基,而M'和N'分子中含有一个甲基。下列是以最基础的石油产品(乙烯、丙烯、丙烷、苯等)及无机试剂为原料合成X的路线:
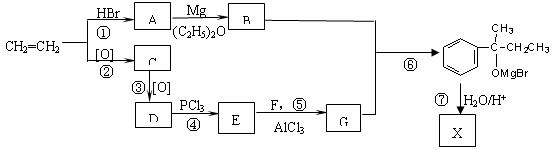
其中C溶液能发生银镜发应。请回答下列问题:
(1)上述反应中属于加成反应的是____________________(填写序号)
(2)写出C、Y的结构简式:C_________ _____ Y ______________
(3)写出X与浓硫酸加热得到M的化学反应方程式为__________________ ___________
过程⑤中物质E+F→G的化学反应方程式为______________________ __________
25.(10分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
物质转化关系:R-CH2OH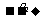 RCHO
RCHO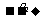 RCOOH
RCOOH
相对分子质量: M M-2 M+14
已知:物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应,物质C的相对分子质量为104。A与其他物质之间的转化关系如下图所示:
请回答下列问题:
(1)F中含有的官能团有 ;G的结构简式 。
(2)一定条件下B发生银镜反应的化学方程式 。
(3)由C、D在一定条件下反应还能生成环状化合物,其化学反应方程式为
。
(4)A的同分异构体很多,写出与A中所含官能团不同,但能与NaOH溶液反应的2种同分异构体的结构简式: 。
24.(8分)实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
___Cu2++___I--___CuI+___I3-
23.(17分)A、B、C、D均为短周期不同主族的元素,分别属于三个不同的周期且原子序数依次增大。A、C可形成原子个数比分别为1∶1和2∶1的两种化合物。A与B能形成一种使湿润红石蕊试纸变蓝的气体X,A与D能形成酸性气体Y。A、B、C能形成一种离子化合物,其水溶液成弱酸性,请写出:
(1)D的元素符号为 ,X极易溶于水的原因是 ,X跟Y反应的化学方程式为 ,A、C形成的原子个数比为1∶1的化合物的电子式为 ,它是 (极性/非极性)分子。
(2)用化学用语解释A、B、C形成的化合物水溶液呈弱酸性的原因是 。
(3)铋(Bi)跟D元素能形成化合物(BiD3),其水解生成难溶于水的(BiOD)。
①BiD3水解反应的化学方程式为 。
②把适量的BiD3溶于含有少量Y的水中,能得到澄清溶液,试分析可能的原因。 。
③医药上把BiOD叫做“次某酸铋”,分析这种叫法是否合理? 。若认为不合理,请说明理由, 。(若认为合理,此空可不作答)。
22.(11分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、D 、E
(2)写出②、③、④的离子方程式:
②
③
④
21.(9分)利用下图装置测定中和热的实验步骤如下:
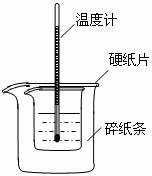
① 用量筒量取50mL 0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度为25.0℃
② 用另一量筒量取50mL 0.55mol·L-1 NaOH溶液,并用另一温度计测出其温度为25.2℃
③ 将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度为28.5℃。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量? ;
(2)倒入NaOH溶液的正确操作是 .(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻的搅动
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容C=4.18 J·(g·℃)-1,请根据该反应中和热的实验值写出中和反应热化学方程式 ;
(5)上述实验中中和热的实验值往往小于理论值,其主要原因是(设操作无误) ,请提出改进措施 。
20.(16分)下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)所需浓H2SO4的体积为______________。(要写计算过程)
(2)如果实验室有15mL、20mL、50mL量筒,应选用_______mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将_________(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的_______里,并不断搅拌,目的是__________________________________________。
(4)将__________________的上述溶液沿______________注入___________________中,并用50mL蒸馏水洗涤烧杯2-3次,洗涤液要_______________________中,并摇匀。
(5)加水至距刻度___________时,改用______________加水,使溶液的凹液面正好跟刻度相平。
19.(6分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。
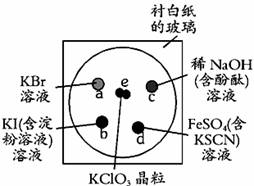
e处:
a处:
c处:
18.0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
第Ⅱ卷(非选择题,共87分)
17.二氧化氮存在下列平衡:2NO2(g)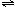 N2O4(g);⊿H<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是
N2O4(g);⊿H<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是
A.温度130℃、压强3.03×105Pa B.温度25℃、压强1.01×105Pa
C.温度130℃、压强5.05×104Pa D.温度0℃、压强5.05×104Pa
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com