
23.下列叙述中正确的是 ( )
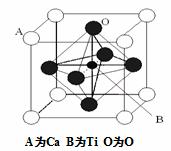
A.一切四面体空间构型的分子内键角均为:109。28,
B.Cu(OH)2能溶于过量氨水形成络合物[Cu(NH3)4]2+,中心离子为Cu2+,配位体是NH3
C.任何晶体,若含阳离子也一定含阴离子
D.水分子稳定是因为水分子间存在氢键作用
22.用“等电子原理”可以判断某些分子或离子的空间构型。已知BF3的空间构型为平面三角形。下列分子或离子中,空间构型也为平面三角形的是 ( )
A.NH3 B.CO32- C.PO43- D.SO2
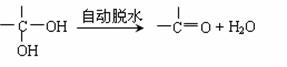
21.(10分)已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:
现有分子式为C9H8O2Br2的物质M,有机物C的相对分子质量为60,在一定条件下可发生下述一系列反应 ( )
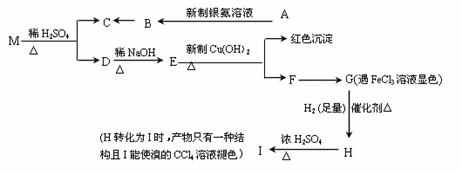
请回答下列问题:
(1)G→H的反应类型是 ______ 。
(2)C的结构简式为 __________ ;M的结构简式为 __________ 。
(3)写出下列反应的化学方程式:
①A→ B的化学方程式: _______ ;
②H→I的化学方程式: ___ 。
《物质结构与性质》模块
22-24为选择题,每小题只有一个正确选项,每小题3分
20.莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是 ( )
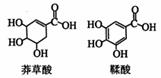
A.两种酸遇三氯化铁溶液都显色
B.鞣酸分子与莽草酸分子相比多了两个碳碳双键
C.中和等物质的量的两种酸所需的氢氧化钠的物质的量相同
D.等物质的量的两种酸与足量金属钠反应产生氢气的量相同
19.下列5个有机化合物中,能够发生酯化、加成和氧化3种反应的是 ( )
①CH2=CHCOOH; ②CH2=CHCOOCH3; ③CH2=CHCH2OH;
④CH3CH2CH2OH; ⑤CH3CH(OH)CH2CHO
A.①③④ B.②④⑤ C.①②⑤ D.①③⑤
18.分子式为C4H10O并能与金属钠发生反应的物质有 ( )
A.3种 B.4种 C.5种 D.6种
17.(10分)烃X是一种重要的化工原料。X能使Br2的四氯化碳溶液褪色,它的密度是同温同压下氢气密度的21倍。由烃X经下列反应可制得A-F等多种有机物。
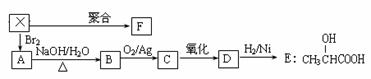
已知:RCH2Br + NaOH → RCH2OH + NaBr
(1)烃X的结构简式为 ,F的结构简式为 。
(2)由X→A、B→C的反应类型分别为 、 。
(4)B转化为C的化学方程式: ;
(5)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物G,G的结构简式为: 。
以下是选考题,其中第18、19、20、21题为《有机化学基础》模块题,第22、23、24、25题为《物质结构与性质》模块题,第26、27、28、29题为《化学与技术》模块题。考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。
《有机化学基础》模块
18-20为选择题,每小题只有一个正确选项,每小题3分
16.(12分).某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是____________。
(2)方案二:按下图装置进行实验。并回答以下问题。
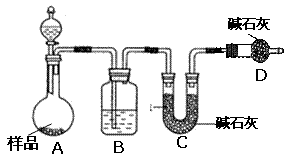
①实验前先__________________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是___________________________________。
②实验中除称量样品质量外,还需称_________________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是 _______________________________________________。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯,漏斗外还用到的玻璃仪器有_______________。
②实验中判断沉淀是否完全的方法是____________________________。
③如加入试剂改为氢氧化钡,已知称得样品10.5g,干燥的沉淀质量为19.7g,测样品中碳酸钠的质量分数为____________。
15.(8分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: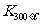 >
>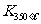 ,则正反应是 热反应。
,则正反应是 热反应。
(2)下图中表示NO2的变化的曲线是 。用O2表示从0-2s内该反应的平均速率v= 。
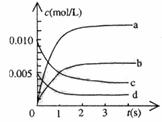
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
14.(10分)中学化学中几种常见物质的转化关系如下:
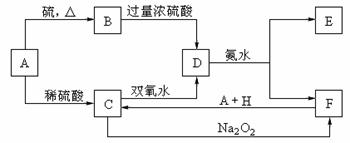
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com