
7.下列离子方程式书写正确的是 ( )
A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B.铝与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
C.碘化钾溶液酸化后滴入少量双氧水:2I-+2H++H2O2=I2+2H2O
D.工业上用三氯化铁溶液腐蚀印刷电路板:3Fe3++3Cu=3Cu2++2Fe
6.下列有关氧化还原反应的说法正确的是 ( )
A.阳离子只有氧化性,阴离子只有还原性
B.失电子的原子获得电子的能力一定强
C.氧化还原反应中的反应物,不是氧化剂就是还原剂
D.非金属元素最高价氧化物的水化物并不一定都具有强氧化性
29.(13分)已知烯烃通过臭氧化并经锌和水处理发生如下变化,其中(I)和(II)均能被H2还原为醇。
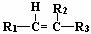
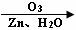
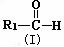 +
+ 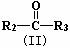 (R1、R2、R3均为烷基)
(R1、R2、R3均为烷基)
(1)上述反应的生成物(I)中含有官能团的名称是
(2)某一氯代烃A分子式为C6H13Cl,它可以发生如下转化:

试回答:
①A→B的反应类型为 。
②若化合物B的某种同分异构体通过臭氧化并经锌和水处理,只得到一种产物且为醛,则上述转化后得到化合物G的结构简式为 。
③若化合物B的某种同分异构体通过臭氧化并经锌和水处理得到甲醛和另一种醛,符合该条件的B的结构有4种,结构简式分别为:CH2=CH-CH2-CH2-CH2-CH3、
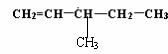 、
、
。
、
、
。
④若经过结构分析表明,化合物B通过加氢反应后分子中生成2个“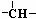 ”(次甲基),则化合物D的结构简式为
,反应E→G的化学方程式为
。
”(次甲基),则化合物D的结构简式为
,反应E→G的化学方程式为
。
28.(18分)2008年9月,中国的三聚氰胺污染牛奶事件,在社会上造成了很坏的影响。牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:
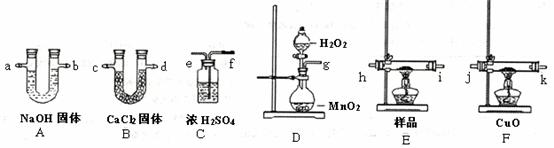
(1)产生的氧气按从左向右流向,所选装置各导管的连接顺序是:g接 、接 、接 、 接 、 接 。
(2)装置C的作用是 ;装置F中CuO的作用是 ;装置D中发生反应的化学方程式是 。
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺分子中碳、氢、氮的原子个数比为 。
(4)目前较多采用以尿素为原料,在0.1MPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式(有机物可用分子式表示) 。
(5)按(1)的连接方法,此实验装置存在的缺点是 ,原因是
27.(15分)A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸、Y是常见的强碱,它们的相互转化关系如下图(部分生成物和水略去)
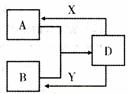
(1)若A、B均为气体,在水溶液中反应生成D,其中A具有漂白性,则A的化学式为 ,B发生催化氧化的化学方程式为 。
(2)若A、B、D含有相同的金属元素,工业用电解熔融氧化物的方法制取该金属单质。则此金属元素在周期表中的位置为 。现将X滴入B的溶液中至过量,观察到的现象是 。
(3)若A为非极性分子,灼烧B、D、Y时火焰均为黄色。写出D+Y→B的离子方程式 。现将标准状况下1.12 L的A通入60 mL l mol/L的B溶液中,则反应后溶液中含有的溶质的物质的量之比(不考虑水解,自定比例顺序) 。
(4)现用图装置电解某浓度Y的水溶液,则下列叙述中不正确的是(填序号) 。
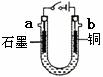
①电解过程中,阴极区溶液pH增大
②电解一段时间后U型管内将有蓝色沉淀产生
③当电路中转移0.02 mol 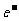 时,阳极质量减小0.64g
时,阳极质量减小0.64g
④a口产生的是氢气,b口产生的是氧气
26.(14分)X、Y、Z为原子序数由小到大排列的三种短周期元素。已知X、Y的氢化物分子具有相同的电子数;Y与Z同主族。XY2是非极性分子,其晶体可用作人工降雨。请回答:
(1)①Z的最高价氧化物对应的水化物W是重要的化工原料,W的化学式为 ;
②在101kPa时,3.2gZ的固体单质完全燃烧可放出29.7KJ的热量,写出能够表示该固体单质燃烧热的热化学方程式 ;
③工业上由ZY2合成ZY3时,结合工业实际,应选用的温度和压强是 (选择字母填空)。
A.400℃一500℃,0.1 Mpa B.400℃-500℃,1Mpa
C.500℃一600℃,10Mpa D.400℃-500℃,100Mpa
|
①写出X单质与W的浓溶液反应的化学方程式 ;
②11.2L ZY2(标准状况)在加热和催化剂作用下与足量的XY发生化学反应,反应中有2mol电子转移,则该反应的化学方程式为 ;
③Z与Fe可组成FeZ2的化合物,是工业制备W的重要原料,假定由FeZ2生成W的每一步原料利用率均为90.0%,请求出用含FeZ2 1.20 t的矿石制备浓度为80.0%的W溶液的质量。(要求写出详细计算过程,结果保留3位有效数字)
13.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H= 一574kJ/mol
②CH4(g)+4NO(g) =2N2(g) +CO2(g)+2H2O(g);△H= 一1160kJ/mol
下列选项不正确的是 ( )
A.通过将氮氧化物转化为N2参与大气循环可消除污染
B.CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g);△H= -867kJ/mol
C.若0.2molCH4还原NO2至N2,在上述条件下放出的热量为287kJ
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为0.8mol
第Ⅱ卷 (非选择,本卷共10题,共174分)
12.某温度下,在体积为5L的密闭容器中,充入lmol A气体,发生如下可逆反应:
2A(g) B(g)+C(?),2min后反应达到平衡,A为0.4mol。当改变反应条件时符合下图的变化(P0表示1个大气压)。则下列叙述中不正确的是 ( )
B(g)+C(?),2min后反应达到平衡,A为0.4mol。当改变反应条件时符合下图的变化(P0表示1个大气压)。则下列叙述中不正确的是 ( )
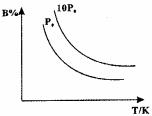
A.0-2min时间内B物质的平均反应速率为0.03mol/(L·min)
B.该反应的正反应是放热反应,且C为非气体物质
C.达到平衡后,保持温度和容器体积不变,再充入1 molA,平衡向正反应方向移动
D.若温度和容器体积不变,起始时充入B和C各0.5mol,则达到平衡时,n(A)小于0.4mol
11.被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素,结构如图所示。有关该化合物的叙述不正确的是 ( )
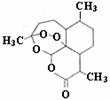
A.分子式为C15H22O5
B.该化合物在一定条件下不能与NaOH溶液反应
C.该化合物中含有过氧结构,一定条件下有氧化性
D.青蒿素属于烃的含氧衍生物
10.常温下,下列情况下,可以大量共存的离子组是 ( )
A.使pH试纸呈红色的溶液中:Fe2+、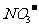 、
、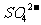 、Na+
、Na+
B.由水电离的c(H+)=l×10-14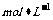 的溶液中:Ba2+、K+、
的溶液中:Ba2+、K+、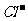 、
、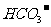
C.在c(H+)/c(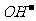 )=1012的溶液中:
)=1012的溶液中: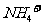 、Al3+、Ca2+、
、Al3+、Ca2+、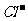
D.与铝反应放出大量氢气的溶液中: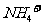 、
、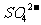 、
、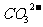 、Na+
、Na+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com