
26.(10分)有四种短周期元素A、B、C、D,其原子序数依次增大,相关性质特点如下表:
|
元素编号 |
相关性质特点 |
|
A |
原子最外层电子数为次外层电子数的2.5倍 |
|
B |
所在主族序数与所在周期序数之差为4 |
|
C |
常温下,0.1mol/LC的最高价氧化物的水化物水溶液pH=13 |
|
D |
元素的最高正价与最低负价的代数和为4 |
请填写下列空白:
(1)写出元素A的名称 ;C的元素符号 。
(2)C2D的水溶液呈(填“酸”、“碱”或“中”) 性,用离子方程式说明原因
。
(3)写出DB2与过量C的最高价氧化物水化物的水溶液反应的化学方程式
。
(4)最近科学家制出A2的同素异形体A4分子,它的结构类似于白磷。已知断裂
1moA≡A键吸收942kJ的能量,断裂1molA-A键吸收167kJ的能量,则A4生成A2的△H= 。
13.取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份。取其中一份用足量的氢气还原,测得反应后固体质量减少3.2g;向另一份加入500mL1.6mol/L稀硝酸,固体恰好完全溶解(硝酸无剩余)且只收集到VL标准状况的NO气体,则V的值为
( )
A.1.12 B.2.24 C.3.36 D.4.48
第Ⅱ卷(非选择题)
12.今有室温下四种溶液:①pH=11的氨水②pH=11的NaOH溶液③pH=3的醋酸④pH=3的硫酸。下列有关说法不正确的是 ( )
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH大小关系为:①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中各离子浓度的大小关系为:
c(NH+4)=c(SO2-4)>c(H+)=c(OH-)
D.若V2 L④与V2L②溶液混合后pH=4,则V1:V2=11:9
11.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:

有关该电池的说法不正确的是 ( )
A.充电时,阴极附近溶液的碱性增强
B.放电时,电解质溶液中的OH-向正极移动
C.充电时,阳极反应:Ni(OH)2-e-+OH+=NiO(OH)+H2O
D.放电时,负极反应:Cd-2e-+2OH-=Cd(OH)2
10.下列实验能达到预期目的的是 ( )
A.向溴乙烷碱性水解后的溶液中加入AgNO3溶液,通过观察沉淀的颜色以检验Br-
B.除去苯中溶有的少量苯酚的方法是加入适量浓溴水,充分反应后,静置、过滤
C.除去NO中混有的少量NO2,可以将混合气体通入水中,再用排空气法收集NO
D.淀粉胶体中混有氯化钠杂质,可用渗析法提纯
9.在浓盐酸中,H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl2-6+6Y,
关于该反应的说法中正确的是组合是 ( )
①H3AsO3是氧化剂,SnCl2-6是氧化产物 ②还原性:Cl->As ③Y为H2O
④每生成0.05molAs,还原剂失去0.15mol的电子 ⑤Y为OH-
A.①③⑤ B.①②④⑤ C.①③④ D.只有①③
8.一定条件下,体积为10L的密闭容器中,2molX和1molY进行反应:
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
A.以Y表示的反应速率为0.001mol·L-1·s-1
B.将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.若在该容器中再通入2molX和1molY,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H<0
7.下列各组离子在给定条件下能大量共存的是 ( )
A.在NO-3存在的强酸性溶液中:NH+4、Ba2+、Fe2+、Br-
B.有CO2-3存在的溶液中:Na+、Mg2+、Al3+、I-
C.能使石蕊变红的溶液中:NH+4、K+、NO-3、Cl-
D.常温下,由水电离出的H+浓度为1×10-13mol·L-1的溶液中:Na+、S2-、HCO-3、SO2-3
6.下列对生产、生活有关化学问题的分析正确的是 ( )
A.光导纤维的主要成分是单质硅,可广泛应用于通讯和医疗领域
B.棉、麻、丝、毛及合成纤维完全燃烧都只生成二氧化碳和水
C.明矾净水是利用了Al3+的氧化性
D.人们用银制器皿盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的一些细菌
27.(16分)I、合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧原子的物质的量之比为4:5,则混合物中FeO与Fe2O3物质的量之比为___________。
(2)当催化剂中FeO与Fe2O3的物质的量之比为1:1时,其催化活性最高,此时铁的氧化物混合物中铁元素的质量分数为_____________。
II、如图A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
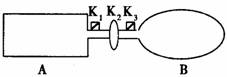
已知:2NO2(红棕色) N2O4(无色)△H<0
N2O4(无色)△H<0
(1)一段时间后反应达到平衡,此时A、B中生成的N2O4的速率是VA______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)将(1)中开启的K2关闭,再向A、B中分别再充入与初始量相等的NO2,则达到新平衡时,A中NO2的转化率将 (填:增大、减小、不变);若通入的是等量的Ne气,则达到新平衡时A中NO2的转化率将 (填:增大、减小、不变),B中NO2的转化率将 (填:增大、减小、不变)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com