
22.在由水电离产生的H+浓度为1×10-13mol/L的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
21.已知NaHSO4在水中的电离方程式为:NaHSO4 = Na++H++SO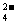 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 ( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 ( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol/L
C.加入NaHSO4晶体抑制了水的电离
D.该温度下加入等体积pH = 12的NaOH溶液可使该溶液恰好呈中性
20.意大利科学家合成一种新型氧分子,它由4个氧原子构成,专家认为它液化后的能量、密度都比普通氧分子高得多,下列关于该分子叙述正确的是 ( )
A.它是氧元素的另一种同位素 B.它是氧元素的另一种同素异形体
C.它的摩尔质量是64 D.它将成为一种新型强力火箭推进燃料
19.在一种无色溶液中,可能存在Na+、Ca2+、Fe3+、Br-、CO32-、SO42-、Cl-中的几种。某学生进行了下列实验:取少量原溶液,向其中滴加足量氯水,有无色无味气体产生,溶液仍为无色;将反应后的溶液分为2份,向其中一份溶液中滴加AgNO3溶液,有白色沉淀产生;向另一份溶液中加BaCl2溶液,有白色沉淀产生。该溶液中一定大量存在的离子组是 ( )
A.Na+、Fe3+、SO42-、 B.CO32-、Cl-、SO42-
C.Ca2+、Br-、SO42- D.Na+、SO42-、CO32-
18.用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m)的超细粉末粒子,然后制
得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )
A.溶液 B.悬浊液
C.胶体 D.乳浊液
17.下列实验中操作及现象与结论对应关系正确的一组是 ( )
|
|
实验操作 |
实验现象 |
实验结论 |
|
A |
适量二氧化碳通入氯化钡溶液中 |
产生白色沉淀 |
碳酸的酸性比盐酸弱 |
|
B |
二氧化硫通入溴水中 |
溶液褪色 |
二氧化硫有漂白性 |
|
C |
取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,振荡、静置 |
溶液分层,下层呈紫红色 |
原无色溶液中一定有碘离子 |
|
D |
淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 |
产生红色沉淀 |
淀粉水解可生成葡萄糖 |
16.有下列三个反应:①Cl2 + FeI2 = FeCl2 + I2 ②2Fe2+ + Br2 =2Fe3+ + 2Br-
③Co2O3 + 6HCl = 2CoCl2 + Cl2↑+ 3H2O,下列说法正确的是 ( )
A.①②③中的氧化产物分别是FeCl2 、Fe3+、Cl2
B.根据以上方程式可以得到氧化性Cl2 > Co2O3 > Fe3+
C.在反应③中生成1mol Cl2时,有2molHCl被氧化
D.根据反应①②一定可以推理得到Cl2 + FeBr2 = FeCl2 +Br2
15.将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是 ( )
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
14.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是 ( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.NaAlO2和H2SO4 D.Na2CO3和HCl
13.下表中所叙述的实验操作完全正确的是 ( )
|
编
号 |
实 验 |
操
作 |
|
A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠, 小心放入装满水的烧杯中。 |
|
B |
配制一定物质的量浓度的氯化钾溶液1000mL |
准确称取氯化钾固体,放入到1000mL的容量瓶中, 加水溶解,振荡摇匀,定容。 |
|
C |
排除碱式滴定管尖嘴部位 的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管, 轻轻挤压玻璃珠,使溶液从尖嘴流出。 |
|
D |
取出分液漏斗中所需的上 层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com