
7.关于晶体的下列说法正确的是 ( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
6.已知:Cu+2Fe3+=2Fe2++Cu2+。现把相同物质的量的CuSO4、FeCl3和Zn置于水中充分反应,反应器中所得混合物除含有SO2-4和Cl-外,还含有 ( )
A.Zn2+、Cu、Fe3+ B.Zn、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe、Fe2+ D.Zn2+、Cu、Cu2+、Fe2+
5.液溴易挥发,实验室保存时加适量水形成水封,液面仍充满红棕色的溴蒸气,现将试剂瓶倾斜,缓慢地向试管中倾倒,则可观察到首先被倒入试管的是 ( )
A.液溴 B.水 C.溴水 D.溴蒸气
4.在加热条件下,下列反应不是氧化一还原反应的是 ( )
A.浓盐酸和二氧化锰 B.氯酸钾和二氧化锰
C.浓硫酸和氯化钠 D.浓硫酸和铜
3.欲除去CO2中混有的少量氯化氢,最好采用的溶液是 ( )
A.浓硫酸 B.石灰水 C.饱和小苏打 D.饱和碳酸钠
2.下列有关工业生产的叙述中,错误的是 ( )
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化成三氧化硫后,在吸收塔内用水吸收制得浓硫酸
D.炼铁的主要原理是在高温下,用还原剂从铁矿石把铁还原出来
1.下列有关叙述正确的是 ( )
A.铜可以导电,所以铜是电解质
B.MgCl2在熔融状态下可导电,它是电解质
C.H2SO4液态时都不导电,它是非电解质
D.能导电的单质一定是金属
0.(2)(6分)04mol KMnO4固体,加热一段时间后,收集到amol气体,在反应后的残留固体中加入足量的浓盐酸又收集到bmol气体,设此时Mn元素全部以Mn2+存在于溶液中,则:
(1)a+b的取值范围为 ;
(2)计算若a+b=0.09mol时,残留固体的质量为多少 克。
21.(1)(8分)工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%。试计算(用含题中字母的代数式表示):
(1)制得氯化氢__________mol。
(2)残液中氯化钠的质量_________________ Kg。
(3)残液中氢氧化钠的物质的量浓度 mol/L。
19.(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
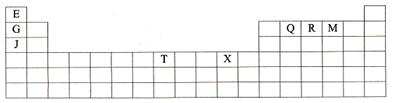
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)下列有关上述元素的说法中,正确的是: (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个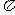 键
键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式:
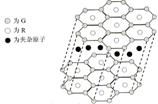
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)
20(10分).铜及其合金是人类最早使用的金属材料。
⑴铜原子的核外电子排布式是 。
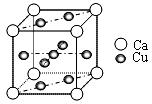
⑵下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 。
⑶Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO
。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 ___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com