
9.下列各组离子在溶液中一定能大量共存的是 ( )
A.PH=0的溶液:K+、Ca2+、HCO-3、NO-3
B.加入铝粉能产生氢气的溶液:K+、Fe2+、SO2-4、NO-3
C.使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO2-4
D.存在较多的Na+、SO2-4、OH-的溶液中:Mg2+、Ba2+、Br-
8.设NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.18gD2O所含电子数为10NA
B.1mol乙炔分子中共用电子对数为5NA
C.1L1mol•L-1的醋酸溶液中,H+的物质的量为NA
D.标准状况下,11.2LSO3所含分子数为0.5NA
7.以下化学用语正确的是 ( )
A.乙烯的结构简式CH2CH2 B.氨气分子的电子式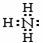
C.明矾的化学式KAlSO4•12H2O D.氯化钠的电子式 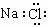
6.下列叙述正确的是 ( )
A.金属与盐溶液的反应都是置换反应
B.阴离子都只有还原性
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.分子晶体中都存在范德华力,可能不存在共价键
21.(8分)将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入120mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液pH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4g蓝色固体。(假设反应前后溶液的体积不变)
计算:(1)已锈蚀的铜片中的铜元素的质量分数为 。(保留两位小数)
(2)求铜片中单质铜的物质的量。(写出计算过程)
(3)若生成NO2和NO混合气体共aL(S.P.T)。
①a的取值范围为 。
②原硝酸的浓度为多少?(只需用a的代数式表示,写出过程)
20.(11分)磷单质及其化合物的有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)==3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
①上述反应中,副产物矿渣可用来 。
②已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示△H,△H= 。
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见下图)之间脱去两个水分子的产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
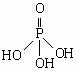
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 。
②化学镀镍的溶液中含有Ni和H2PO2,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2 + → Ni+ + H2PO3-- +
(b)6H2PO2+2H+ =2P + 4H2PO3-
+ 3H2↑
请写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;
原理上的相同点: ;
化学镀的优点: 。
19.(10分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化:
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 (填字母)。
A.向装置中充入N2 B.向装置中充入过量的O2
C.使用更高效的催化剂 D.升高温度
(2)在一密闭容器中充入4 mol SO2和一定量O2,当放出353.6 kJ热量时,SO2的转化率最接近于 (填字母)。
A.40% B.50% C.80% D.90%
(3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g) 2SO3(g)的平衡常数K=
。
2SO3(g)的平衡常数K=
。
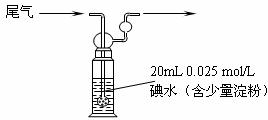
(4)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放。现用下图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况下测定)时,碘水恰好褪色。通过计算说明,该尾气能否直接排放(写出计算过程)。 。
18.(10分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
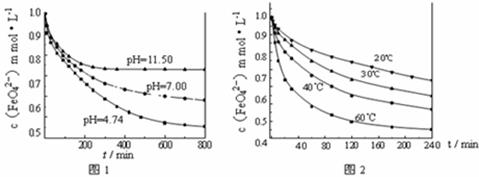
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
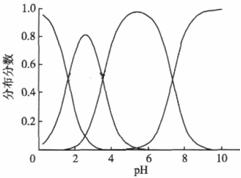
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点,消耗(NH4)2Fe(SO4) 2溶液V1 mL。滴定时发生的反应为:
Fe2++Cr2O72-+H+→Fe3++Cr3++H2O(未配平)
①写出步骤2中发生反应的离子方程式 。
②根据上述实验数据,测定该溶液中K2FeO4的浓度为 mol·L-1(用含字母的代数式表示)。
17.(10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:
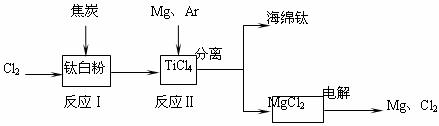
①Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
②Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为 。
(2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ;反应Ⅱ的热化学方程式为 。
(3)该工艺流程中,可以循环使用的物质有 。
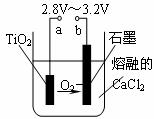
(4)在800℃-1000℃时电解TiO2也可制得海绵钛,装置如下图所示。图中b是电源的 极,阴极的电极反应式为 。
16.(8分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
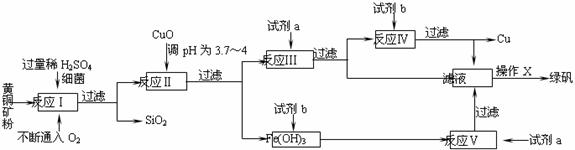
已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是 ,试剂b是 。
(2)操作X应为蒸发浓缩、 、 。
(3)反应Ⅱ中加CuO调pH为3.7-4的目的是 ;
(4)反应Ⅴ的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com