
5.室温下,强酸性溶液中能大量共存的离子组是 ( )
A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、SO32- S2-
C.K+、Na+、AlO2-、SO42- D.Ba2+、Fe2+、NO3-、Br-
4.下列实验中指定使用的仪器必须预先干燥的是 ( )
 A.中和滴定盛装标准溶液的滴定管
A.中和滴定盛装标准溶液的滴定管
 B.配置一定物质的量浓度溶液使用的容量瓶
B.配置一定物质的量浓度溶液使用的容量瓶
 C.中和滴定中使用的锥形瓶
C.中和滴定中使用的锥形瓶
 D.喷泉实验中盛装氨气的圆底烧瓶
D.喷泉实验中盛装氨气的圆底烧瓶
3.据2007年12月18日的《新民晚报》报道,上海市从12月17日起空气质量日报中增加了一种污染气体的预报,该气体是 ( )
A.氮氧化物 B.氮气 C.臭氧 D.可吸入颗粒物
2.下列叙述中错误的或违背化学原理的是 ( )
 A.能形成+7价的含氧酸及其盐的元素不一定是主族元素
A.能形成+7价的含氧酸及其盐的元素不一定是主族元素
 B.用金属钠检验乙醇中是否含有少量水
B.用金属钠检验乙醇中是否含有少量水
 C.等质量的苯和乙烯完全燃烧耗氧量不相等
C.等质量的苯和乙烯完全燃烧耗氧量不相等
 D.“冰,水为之,而寒于水” 说明相同质量的水和冰,水的能量高
D.“冰,水为之,而寒于水” 说明相同质量的水和冰,水的能量高
1.下列物质不能与二氧化硫气体反应的是 ( )
A.品红溶液 B.氯水 C.浓硫酸 D.碱石灰
30.(12分)某化学研究小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,在实验室中按以下步骤进行实验:
①称取ag样品,置于烧杯中;
②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀物移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,冷却至室温后,称量;
⑦……
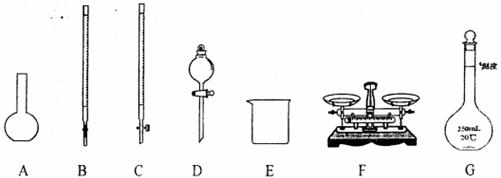
请根据上面叙述,同答:
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和 。(填仪器序号);
(2)检验沉淀是否洗净,应向洗涤液中加入几滴 (填写序号);
①KSCN溶液 ②NaOH溶液 ③AgNO3溶液 ④酚酞试液
(3)步骤④中FeCl2中Fe元素所发生变化的化学方程式为 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,其原因可能是
(答出两点即可);
(5)若坩埚质量是W1g,最终坩埚和固体的总质量是W2g,则样品中铁元素的质量分数为
29.(8分)铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究。
Ⅰ.查阅资料:
①Cu2O属于碱性氧化物;
②在空气中灼烧Cu2O生成CuO;
③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O)。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为ag,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量。如此反复多次直到质量不变,称得最后质量为C g。分析数据,作出合理判断。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
(2)方案3中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O。
28.(7分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
2BrO3一+10I一+12H+=5I2+Br2+6H2O 6BrO3一+5I一+6H+=5IO3一+3Br2+3H2O
②Br2能将I一氧化为I2:Br2+2I一=2Br-+I2
③KIO3能将I-氧化为I2,也能将Br一氧化成Br2,其本身被还原为I2。
IO3-+5I-十6H+=3I2+3H2O 2IO3-+10Br-+12H+=I2+5Br2+6H2O
(1)在上述反应涉及的粒字中氧化性最强的是 (填化学式,下同);
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为 ,还原产物为 ;
(3)向含有1 mol KI的硫酸溶液中加BrO3溶液,若反应后的碘元素只存在于I2中,溴元素只存在Br一中,则加入KBrO3的物质的量为 mol;
(4)将6mL 0.4mol·L-1 KBrO3溶液和10 mL 0.4 mol·L一1 KI溶液在稀H2SO4中混合。写出发生反应的离子方程式 。
27.(13分)铝土矿的主要成分是A12O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取A12O3。回答下列问题:
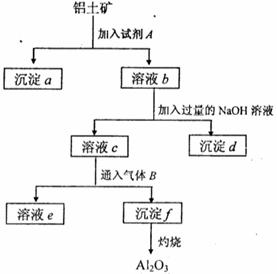
(1)沉淀物的化学式分别是:
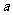 ;
;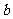 ;
;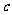 ;
;
(2)写出加入过量NaOH溶液时所发生主要反应的离子方程式 。
(3)写出通入气体B(过量)时溶液C中发生反应的离子方程式 。
(4)气体B能否改用试剂A代替?为什么? 。
26.(10分)实验室用同体烧碱配制500 mL 0.32mol·L-1的NaOH溶液。
①需称量 g的烧碱固体,固体应放在 中置于天平右盘称量。
②配制过程中,不需要使用的仪器是(填符号) 。
A.烧杯 B.量筒 C.玻璃棒 D.l000mL容量瓶 E.漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是 (填仪器名称)。
④由于操作上的不规范,下列使所配溶液的物质的量浓度偏低的是 : 偏高的是 :
A.称量时药品和砝码位置颠倒
B.称量时间过长
C.溶液未冷却即转入容量瓶
D.容量瓶洗净后未烘干
E.定容时俯视刻度线
F.定容后倒转摇匀,发现液面低于刻度线而未加水补充
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com