
29.Ⅰ.(8分)在测定硫酸铜结晶水的实验操作中:
(1)加热前应将晶体放在__________中研碎,加热是放在__________中进行,加热失 水后,应放在__________中冷却。
(2)判断是否完全失水的方法是______________________________________________。
(3)做此实验,最少应进行称量操作_________次。
某同学进行胆矾结晶水测定实验,得①~④组数据:
|
编号 |
加 热 前 |
加 热 后 |
|
|
坩埚质量(g) |
坩埚+胆矾质量(g) |
坩埚+无水CuSO4质量(g) |
|
|
① |
5.0 |
7.5 |
6.6 |
|
② |
5.42 |
7.95 |
6.8 |
|
③ |
5.5 |
8.0 |
7.1 |
|
④ |
5.0 |
7.5 |
6.8 |
(4)实验数据表明有两次实验失误,失误的实验是___________
A.①和② B.②和④ C.①和③ D.③和④
(5)若该生测定结果偏高,则从下列分析中选出该学生产生实验误差的原因可能是___________
A.加热前称量时容器未完全干燥
B.最后两次加热后的质量相差较大
C.加热后容器未放入干燥器中冷却
D.加热过程中有少量溅失
Ⅱ.(6分)50mL0.50 mol·L-1盐酸和50mL 0.55 mol·L-1烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热,回答下列问题:
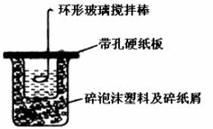
(1)从实验装置上看,图中尚缺少一种玻璃仪器是_________。
(2)烧杯间填满碎纸屑的作用是________________。
(3)大烧杯若不盖硬纸板,求得的中和热数值将____(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL 0.50 mol·L-1的盐酸跟50mL 0.50 mol·L-1的烧碱溶液进行上述反应,与上述实验相比,所放出的热量_________(填“相等”或“不等”),所示的中和热____________,(填“相等”或“不等”)
(5)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则最终代入计算式的温差均值为__________℃。
28.(8分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,立体结构类型相同的氢化物的沸点从高到低排列次序是:(填化学式)
(5)载人飞船推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2)。当它们混合反应时,即产生大量N2和H2O(g),并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成N2和H2O(g),放出256.652 kJ的热量。则该反应的热化学方程式为:
。
27.(6分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论。
实验①________________________________________。
实验②_______________________________________。
实验③________________________________________。
实验④________________________________________。
实验⑤________________________________________。
(2)上述5个实验不能确定是否的离子是___________________。
26.(4分)有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸溶胶、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:(1)电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入到丙中,先出现浑浊,后液体变清。则甲为 ,乙为 ,丙为 ,丁为
25.(8分)配平下列离子方程式,并回答问题:
(1) Fe(OH)3+ +ClO-+ OH-= FeO4n-+ Cl-+ H2O
(2)若有3.21gFe(OH)3参加反应,共转移了5.418×1022个电子,则n= ,
FeO4n-中铁的化合价为 。
(3)试推测FeO4n-能与下列哪些物质反应(填序号) 。
A.Cl2 B.SO2 C.H2S D.O2
24.化学反应N2+3H2 = 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
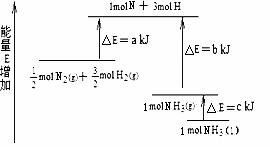
A.N2(g)+3H2(g)=2NH3(l);
△H =2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);
△H = 2(b-a)kJ·mol-1
C.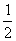 N2(g)+
N2(g)+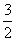 H2(g)= NH3(l);
H2(g)= NH3(l);
△H = (b+c-a)kJ·mol-1
D.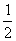 N2(g)+
N2(g)+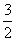 H2(g)=NH3(g);△H =(a+b)kJ·mol-1
H2(g)=NH3(g);△H =(a+b)kJ·mol-1
第Ⅱ卷 非选择题 52分
23.下列有关说法正确的是 ( )
A.物质熔沸点的高低顺序是:晶体硅>氯化钠>冰>氖气
B.微粒半径由大到小顺序是:Li+>H->H+
C.溶液中结合H+能力由强到弱的顺序是:SO42- >H2PO4->CH3COO->HCO3-
D.CO2、HClO、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构
22.下列关于热化学反应的描述中正确的是 ................ ( )
A.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的
ΔH=+2×283.0 kJ·mol-1
B.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
21.下列说法正确的是 ( )
A.在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热
C.燃烧热或中和热是反应热的种类之一
D.在稀溶液中,1 mol CH3COOH和1 mol NaOH完全中和时放出的热量为57.3 kJ
20.能正确表示下列反应的离子方程式是 ( )
A.足量的硫酸铝与纯碱反应:
2Al3++3CO32-+3H2O===2Al(OH)3↓+3CO2↑
B.硫酸铜与烧碱反应:CuSO4+2OH-===Cu(OH)2↓+SO42-
C.苯酚与碳酸钠反应:2C6H5OH+CO32-===2C6H5O-+CO2↑+H2O
D.制取Fe(OH)3胶体:Fe3+ +3H2O 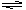 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com