
5.现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为 ( ) A.1∶1∶1 B.1∶2∶3
C.3∶2∶1 D.6∶3∶2
4.某原子的摩尔质量是M g•mol-1,则一个该原子的真实质量是 ( )
A.M g B.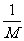 g
g
C.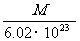 g D.
g D.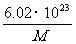 g
g
3.下列操作常用于除去液态混合物中易挥发、难挥发或不挥发的杂质的实验方法是( )
A.过滤 B.蒸馏 C.渗析 D.萃取分液
2.试管是化学实验中最常用的玻璃仪器,对试管加热时,下列操作正确的是 ( )
A.试管外壁有水珠不一定要擦干,加热时会自然挥发
B.应握紧试管夹,大拇指按在短柄上
C.试管中液体的量不能超过试管容积的1/3
D.可以使试管的受热部位在火焰上方先上下移动,后集中加热
1.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为 ( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,滤液中补加适量硝酸
B.加入过量碳酸钾溶液,过滤,除去沉淀,滤液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,滤液中补加适量硝酸
D.加入过量硫酸钾溶液,过滤,除去沉淀,滤液中补加适量硝酸
21.(14分)2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
① MnO4-+ Cu2S+ H+= Cu2++ SO2+ Mn2++ H2O
②6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O 反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应,反应式为:
③ MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 请回答:
(1)配平KMnO4与Cu2S反应的离子方程式并用单线桥标出电子转移:
MnO4-+ Cu2S+ H+= Cu2++ SO2+ Mn2++ H2O
若标准状况下有1.12 L SO2生成,则转移电子的物质的量是 。
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 ______g,配制时所需要的定量仪器是 。
(4)混合物中Cu2S的质量分数为 。
20.(11分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(3)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(4)画出D的核外电子排布图___________________________________________。
19. (12分)向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2 ,充分反应,测得最后溶液的pH>7。
(12分)向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2 ,充分反应,测得最后溶液的pH>7。
 (1)此时溶液的溶质若是单一成分,可能是 或
;如果是多种成分,可能是
或
。
(1)此时溶液的溶质若是单一成分,可能是 或
;如果是多种成分,可能是
或
。
 (2)在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示。
(2)在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示。
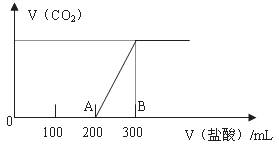
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式
②产生的CO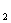 在标准状况下的体积为
mL
在标准状况下的体积为
mL
③B点时,反应所得溶液中溶质的物质的量浓度是
mol·L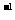 (溶液体积的变化忽略不计)
(溶液体积的变化忽略不计)
18.(6分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。 。
(3)在100mL0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。 。
17.(9分)5·12大地震后在灾区使用了多种消毒剂,高锰酸钾是其中之一。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
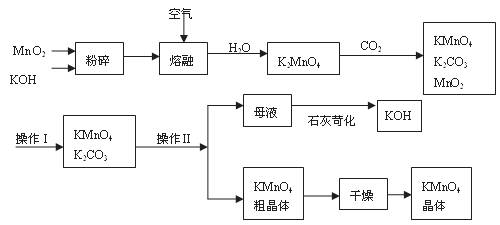
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a.浓硝酸 b.硝酸银 c.氯水 d.纯碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。 a.石灰石 b.稀HCl c.稀H2SO4 d.纯碱
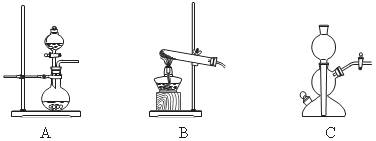
所需气体发生装置是_____________(选填代号)。
(5)操作Ⅰ的名称是__________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上的差异,采用__________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com