
3.下列说法正确的是( )
A.熵增大的反应一定可自发进行 B.熵减小的反应一定可自发进行
C.ΔH<0的反应可能自发进行 D.ΔH>0的反应不可能自发进行
2.下列反应既属于氧化还原反应,又是吸热反应的是 ( )
A.铝片与盐酸的反应 B.灼热的碳与CO2的反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在氧气中的燃烧反应
1.已知在1×105 Pa,298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g) = H2(g) + 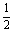 O2 (g) △H = +242 kJ/mol
O2 (g) △H = +242 kJ/mol
B.2H2(g) + O2 (g) = 2H2O (l) △H = -484 kJ/mol
C.H2
(g) + 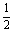 O2 (g) = H2O (l) △H = -242 kJ/mol
O2 (g) = H2O (l) △H = -242 kJ/mol
D.2H2 (g) + O2 (g) = 2H2O (g) △H = +484 kJ/mol
21.(8分)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人血液中Ca2+的浓度为2.2×10-3-2.7×10-3mol·L-1。
已知:2KMnO4+ 5H2C2O4+3H2SO4 = 2MnSO4 + K 2SO4+10 CO2↑+8 H2O
现抽取某人血样20mL,稀释后用草酸铵(NH4)2C2O4溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4);溶解得到的草酸与2.0 mL 5.0×10-3 mol·L-1 KMnO4溶液恰好完全反应。根据上述信息,求此人血液中Ca2+的浓度,并判断其血液含钙量是否正常。
20.(15分)按要求回答下列各题:
(1)VL硫酸铁溶液中含有mg Fe3+,则溶液中SO42-的物质的量浓度为___________ ,硫酸铁的物质的量浓度为 ________________。
(2)实验室常用浓盐酸的质量分数为36.5﹪,密度为1.20g·cm-3。
①此盐酸的物质的量浓度为____________。
②配制100mL3.00 moL·L-1的盐酸,需以上浓盐酸的体积为____________mL。
③用浓盐酸配制3.00 mol·L-1稀盐酸,操作步骤的正确顺序是 (填序号)。
a.计算需要浓盐酸的体积。
b.用量筒量取浓盐酸。
c.将烧杯中的溶液注入100 mL容量瓶中, 并用少量蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液也注入容量瓶。
d.把量好体积的浓盐酸倒人烧杯中,加适量蒸馏水稀释,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下l-2 cm处,改用胶头滴管小心滴加蒸馏水至凹液面与刻度线相切。
19.(9分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列各题。
(1)所含铁元素既有氧化性又有还原性的物质是 (用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,该分散系中微粒直径的范围是 nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式: ;检验反应后的溶液中存在Fe3+的试剂是 。
18.(15分)A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl-、NO3-、CO32-中不同的阴、阳离子所组成。经实验A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为 、B为 、C为 。
写出A 与盐酸反应的离子方程式 。
写出B 与盐酸反应的离子方程式 。
17.(13分)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是 。

(2)为防止氯气尾气污染空气,实验室通常用_____________溶液吸收多余的氯气,原理是(用化学方程式表示)_________________________________________。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是_______(用字母代号填)。
A.NaOH B.NaCl C.KCl D.Na2CO3
16.下列各组物质反应可以用同一离子方程式表示的是
A.H2SO4和NaOH 、HNO3和Ba(OH)2
B.H2SO4和Ba(OH)2 、BaCl2和Na2SO4
C.HCl和NH3·H2O 、CH3COOH和NaOH
D.H2SO4和NaOH、H2SO4和Cu(OH)2
第Ⅱ卷(非选择题,共60分)
15.下列电离方程式中,正确的是
A.Al2(SO4)3 === 2Al3+ + 3SO42- B.Na2CO3 === Na2+ + CO32-
C.KOH === K+ + OH- D.NaHCO3 === Na+ + H+ + CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com