
7.下列有关物质性质的比较中,正确的是 ( )
A.熔点:CO2<H2O<SiO2<KCl B.粒子半径:K+>Na+>Mg2+>Al3+
C.酸性:H3PO4>H2SO4>HClO4>H2SiO3 D.稳定性:H2O<NH3<PH3<SiH4
6.NA为阿伏加德罗常数,下列说法正确的是 ( )
A.1molD2O所含质子数为12NA
B.通常状况下将0.5molHI气体和0.5molCl2混合后,气体的分子数为NA
C.2.4g金刚石中约含有0.4NA个C-C键
D.常温下,100mL1mol·L-1AlCl3溶液中阳离子总数小于0.1NA
30.(每空2分,共14分)A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l:1和1:2的两种离子化合物X、Y,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)X的电子式为 ,C的原子结构示意图为 A、B的气态氯化物更稳定的是 (填化学式)
(2)单质D在CO2中燃烧的化学方程式为
(3)2molC的氢氧化物与2molB单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式
(4)常温下,B、C形成的化合物的水溶液中所有离子的物质的量浓度由大到小的顺为?
(5)8gA单质和氢气反应,常温常压下,放出142.9kJ的热量,写出该反应的热化学方程式。
29.(每空2分,共14分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验
|
实验序号 |
实验内容 |
实验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准状况下的体积) |
|
3 |
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量:再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”):根据实验3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子:及其物质的浓度(可不填满):
|
阳离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
|
|
|
(3)根据实验对K+是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”)
28.(每空2分,共20分)为了证明在实验室制备C12的过程中会有水蒸气雨和HC1挥发出来,甲同学设计了如图所示的实验装置,按要求同答问题。
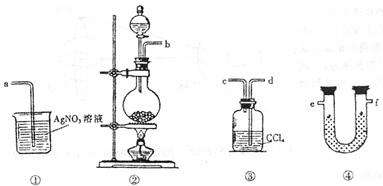
(1)袋置②中盛装固体和液体的玻璃仪器名称为 和 。
(2)请根据甲同学的意图连接相应的装置,接口顺序:b接 接 接a。
(3)U形管中所盛试剂的化学式为 。
(4)装置③中CC14的作用 。
(5)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号):瓶中可以放入 。
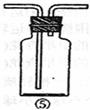
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成 ,如果观察到 的现象,则证明制C12时有HC1挥发出来。
27.(每空3分,共12分)用98%(密度为1.84g/cm3)的浓硫酸配制3mol/L的稀硫酸100mL。回答下列问题:
(1)浓硫酸的物质的量浓度为 ,需要用量筒量取浓硫酸的体积为 。
(2)配制操作可分解成如下几步,正确的操作顺序是(填序号) 。
A.根据计算,用量筒取一定体积的浓硫酸
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.将冷却的稀硫酸注入已检查不漏水的容量瓶中
D.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
E.盖上容量瓶塞于,振荡,摇匀
F.用胶头滴管加蒸馏水,使溶液叫液面恰好与刻度线相切
G.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线l-2cm
(3)由于错误操作,使制得的稀硫酸溶液浓度偏小的是(填序号) 。
A.用量筒量取一定液体时,俯视液面读数
B.使用容量瓶配制溶液时,俯视液面定容后所得溶液浓度
C.没有用蒸馏水洗涤烧杯2-3次,并将溶液移入容量瓶中
D.容量瓶用蒸馏水洗净,没有烘干
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配制好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
13.最近意大利罗马人学Fulvio Cacace等人获得了极且理论研究意义的N4分子。N3分子结构如下图所示,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是 ( )

A.N4属于一种新型的化合物
B.1melN4气体转变为N2将吸收882kJ热量
C.N4沸点比P4(白磷)高
D.N4与N2互为同素异形体
第Ⅱ卷
12.下列判断中一定正确的是 ( )
A.CaCl2及CaO2固体中阴、阳离子数之比均为2:1
B.等质量的O2与O3中,氧原子的个数比为3:2
C.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D.10mL0.3mol·L-1NaCl与30mL0.1mol·L-1。A1C13中C1-物质的量浓度比为1:3
11.下列再组离子中可以大量共存于同种溶液中,且加入过量氢氧化钠溶液或过量稀硫酸时都能产生白色沉淀的是 ( )
A.K+、Ba2+、C1-、HCO3- B.Na+、A13+、C1-、Ba2+
C.Ba2+、Mg2+、NO3-、CO32- D.H+、Ba2+、Fe2+、NO3-
10.氮化铝(AIN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
A12O3+N2+3C
下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂, A12O3是氧化剂
B.上述反应中每生成2mo1AlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为一3价
D.氮化铝晶体属r分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com