
24.(1)(113,450) (2)-2,+4 ,+6 (3)H2Te、H2Se、H2S(1分)
(4)还原性,(1分) 2H2Se + O2 2Se + 2H2O (1分)
2Se + 2H2O (1分)
(5)_1_A12Te3 + (6 H2O) → 2A1(OH)3↓ +3H2Te↑(1分)
(6)硫, 碲(每空各1分)
24、(奉贤一)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是 (2)碲的化合价可能有
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
 (4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
 ____A12Te3
+ ( ) A1(OH)3↓ + H2Te↑
____A12Te3
+ ( ) A1(OH)3↓ + H2Te↑
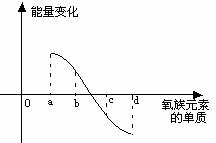
(6)右图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
23.(1)C:钠 E:1s22s22p63s23p5。(2) Na+ [ O H]- (3)O2-﹥Na+﹥Al3+
(4)①Cl2 + 2OH-→Cl- + ClO- +H2O ②2Al + 2NaOH + 2H2O→2NaAlO2 + 3H2↑
③2Na2O2 +2H2O→4NaOH + O2↑ Na2O+H2O→2NaOH
23.(嘉定一)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
|
元素编号 |
元素特征信息 |
|
A |
其单质是密度最小的物质 |
|
B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
|
C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
|
D |
其氢氧化物和氧化物都有两性,与C同周期 |
|
E |
与C同周期,原子半径在该周期中最小 |
(1)写出C元素的名称: __________,E元素原子的核外电子排布式_______________。
(2)写出A、B、C形成的化合物的电子式________________。
(3)B、C、D的离子半径由大到小的顺序是(用化学式表示)_____________________。
(4)①E单质与A、B、C形成的化合物的水溶液反应的离子方程式为
_______________________________________________________________。
②D单质与A、B、C形成的化合物的水溶液反应的化学方程式为
_______________________________________________________________。
③B、C元素形成的化合物与A2B反应两个化学方程式分别为
__________________________________、 ______________________________________。
23.(静安一)元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
+2价阳离子的核外电子排布与氖原子相同。 |
(1)上表中与A属于同一周期的元素是(写元素符号) ________;写出D离子的电子排____________。
(2)D和C形成的化合物属于____________晶体。
写出C单质与水反应的化学方程式__________________________________________________。
(3)对元素B的单质或化合物描述正确的是______
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是(写元素符号) ________。写出能证明该结论的一个实验事实_____________________________________________________________________________。

23.(青浦一)现有部分短周期主族元素的有关信息,如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
核外有5种不同能量的电子,其中有2个未成对电子 |
|
X |
最高化合价为+7价 |
|
Y |
短周期主族元素原子中半径最大 |
|
Z |
地壳中含量最多的金属 |
⑴.T的一种单质相对分子质量为256,能溶于CS2,该单质的分子式为____________(用元素符号表示);指出T单质的一种用途_____________________________。
⑵.Z的单质常用来从一些金属氧化物中冶炼难熔的金属,其原因是
;下列酸中不能溶解Z单质的是 。
a. 浓硝酸 b. 热浓硫酸 c. 浓盐酸 d. 稀硝酸
⑶.可用于扑灭Y单质燃烧引起的火灾的物质是___________。
a. 二氧化碳 b. 水 c. 沙土 d. 干粉(主要成分为NaHCO3)
⑷.元素X元素T相比,非金属性较强的是__________(用元素符号表示)。下列表述中能证明这一事实的是____________。
a. 在溶液中T的单质能置换出X的单质
b. X的气态氢化物比T的气态氢化物更稳定
c. T的无氧酸钠盐溶液pH>7,而X的+7价含氧酸钠盐溶液pH=7
⑸.四种元素的最高价氧化物中Z的最高价氧化物的化学特性是____________________。
23⑴. S8 1’ ;制硫酸(或制农药、火药、药皂等) 1’
⑵.Al单质具有较强的还原性,铝热反应会放出大量的热量 1’ ;a 1’
⑶.c ⑷.Cl b ⑸.呈两性
23、(1)Cl 硅 1s22s22p6 3s23p2
(2) 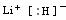
(3)共价键 NH4++H2O
 NH3•H2O + H+ (4)F c (每空1分)
NH3•H2O + H+ (4)F c (每空1分)
23.(南汇一)下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
|
|
c |
d |
e |
f |
|
|
|
|
|
|
|
|
g |
|
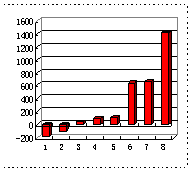
(1)第三周期8种元素按单质熔点(℃)大小顺序的示意图(上左图),其中序列“2”代表__________(填元素符号);序列“8”代表__________(填名称),其原子的电子排布式为 。
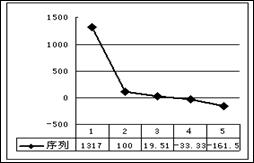
(2)b、c、d、e、f的氢化物沸点直角坐标图(上右图),序列“1”的氢化物的电子式为:____________。
(3)a、d两元素可以形成一种含5原子的10电子微粒,该微粒含有的化学键是 ,该微粒在水溶液中呈酸性的原因是(用离子方程式表示) 。
(4)元素f与元素g相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a、 常温下g单质的颜色比f单质的颜色深
b、 f的单质通入g的钠盐水溶液不能置换出单质g
c、 f与g形成的化合物中g元素呈正价态
23、(闸北一)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
T |
X |
Y |
Z |
|
性质 结构 信息 |
原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子式 ;写出Z元素原子的核外电子排布式: ;元素Y的原子核外共有______种形状不同的电子云。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式
(3) 元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深 b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
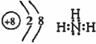
(1) 1S22S22P63S23P1 ; 2 种 (各1分,共4分)
(2)2Al + 2OH- + 2 H2O → 2 AlO2-+ 3 H2↑ (1分) (3) F (1分) b、c (2分)
23.(1)(2分) 第三周期IIIA族 (2)(2分)CO 金属阳离子氧化性强弱不同
(3)(1分)d (4)(3分)Al(OH)3 AlO2-
+H+ +H2O
 Al(OH)3
Al(OH)3
 Al3+
+3OH-
Al3+
+3OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com