
23.(闵行二)(8分)现有W、X、Y、Z四种元素,其结构与性质的描述如下表:
|
元素编号 |
元素结构及性质信息 |
|
W |
短周期元素,室温下其单质为黄绿色气体,其最高价氧化物的水化物为最强的含氧酸。该元素的最低价为-1价。 |
|
X |
短周期元素,单质在常温、常压下为固体,其氧化物为常见大气污染物之一。其原子的M层有2个未成对的p电子。 |
|
Y |
生活、生产上用途较广的金属元素,其常见化合价为+2、+3价。其高价氧化物为棕红色,常用作颜料。 |
|
Z |
短周期元素,原子最外层电子层上s电子数等于p电子数。单质为空间网状晶体,具有很高的熔、沸点。 |
(1)写出W原子的最外层电子的轨道表示式 ;元素X的原子核外有__________种不同运动状态的电子。
(2)在一定条件下,W与Y的单质发生化学反应,生成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”),试用离子方程式解释其原因:__________________________________。
(3)X、Z两元素非金属性较强的是 (写元素符号)。写出证明这一结论的一个事实 。
(4)关于元素Z的说法一定正确的是______________(选填编号)。
A.单质能与碱溶液反应 B.单质可以在空气中燃烧
C.最高价氧化物熔点很高 D.最高价氧化物能溶于水呈酸性
23.(1)第三周期、ⅦA族1s22s22p63s23p1(2)2Al+3S Al2S3
Al2S3
(3)氮气分子中氮氮键为氮氮叁键,键长短,键能大,难以打断。NH3+H2O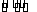 NH3·H2O
NH3·H2O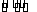 NH4++OH-(4)吸水性、脱水性、强氧化性
NH4++OH-(4)吸水性、脱水性、强氧化性
23. (市调研)A-D是原子序数在20以内的元素,其性质或结构信息如下表:
|
元素 |
A |
B |
C |
D |
|
性质或结构信息 |
其单质是一种本身有毒又可用来消毒的有色气体 |
该元素在人体中累积超过一定量会造成老年痴呆症 |
原子核外p电子数比s电子数少1 |
带二个单位负电荷的阴离子其核外电子层结构与Ar原子相同 |
请根据表中的信息回答下列问题:
(1)A元素在元素周期表中的位置是___________________________________,B原子核外电子排布式为_________________________________。
(2)B和D形成的化合物只能用干法制取,其化学方程式是_________________________。
(3)C的单质特别稳定,原因在于________________________________________________;在C的氢化物的水溶液中存在平衡:______________________________________________。
(4)D的最高价氧化物对应水化物的浓溶液所具有的特性有:_______________________、_______________________、_______________________。
23. (1)氢(1分)(2)第二周期、ⅣA(1分)1s22s22p63s23p5(各1分)
(3)Cl(1分)(4)B、C(2分)(5)B、D(2分)
23.(十四校二)四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
 信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。请根据上述信息回答下列问题。
(1)甲、乙、丙中含有共同元素是 (填名称)。
(2)B元素在周期表中的位置 ,写出A原子的电子排布式 。
(3)上述元素的原子M层有一个未成对P电子数的是 (填元素符号)。
(4)B形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
(5)A、B、C分别和D形成的化合物a、b、c。这些化合物分子的沸为的高低顺序可能为 。
A.a>b>c B.b>c>a C.a>c>b D.c>b<a
23.(浦东一下表为部分短周期元素的性质或原子结构
|
元素编号 |
元素性质或原子结构 |
|
W |
原子序数=周期数=族序数 |
|
X |
原子核外p电子数比s电子数多1 |
|
Y |
最高价氧化物对应水化物是一元强酸 |
|
Z |
所形成的离子与氖原子核外电子排布相同且带2个单位电荷 |
(1)X元素可能是 (填元素符号)
(2)若原子半径X<Y,且X、Y属同族元素,则X、Y分别与W形成的气态化合物的稳定性为
> (填化学式),Y与W形成化合物的电子式为 。
(3)若原子序数X<Y,且X、Y属同周期,X的单质是生活中常用的金属,则X、Y元素的最高价氧化物对应水化物的酸性强弱为 < (填化学式)。
(4)Z与W可形成一种化合物,常作溶剂,该化合物属 分子(填“极性”或“非极性”)。
(5)写出由W、Y、Z三种元素组成的两种化肥的化学式 、 。
23.(1)C (2)第二周期IIA族 :C1:C1:
(3)2, 硫(4)H2S+C12→2HC1+S A1(OH)3+OH-→A1O2-+2H2O
23.(十四校一)五种元短周期元素有关数据如表。其中的X是表示元素原子在分子内吸收电子能力的大小,X越大,原子吸引电子的能力越强,其最大值为4.0,最小值是0.7。试回答下列问题:
|
元素编号 |
A |
B |
C |
D |
E |
|
X |
3.5 |
3.0 |
X3 |
1.5 |
1.5 |
|
主要化合价 |
-2 |
+7 |
+6 |
+3 |
+2 |
(1)X3的值应该为( )
A.3.6 B.3.1 C.2.5 D.1.4
(2)E元素在元素周期表中的位置是 ,B元素单质的电子式为 。
(3)A元素的原子中有 个未成对电子。A、B、C元素形成的单质中,结构微粒间作用力最强的是 (写物质名称)。
(4)用一个化学反应可以证明B和C非金属性的强弱,写出该反应的化学方程式:
。
用一个化学反应也可以证明D元素和与D元素同周期且原子半径最大的元素(非零族)的金属性的强弱,写出该反应的离子方程式:
。
23、(1) H2 (1分) (2) NH4NO3(1分)、HNO3 (1分)(3) 二、VIIA (1分) HF (1分)
(4) 2Na+2H2O→2NaOH+H2↑(1分)2NaOH+2Al+2H2O→2NaAlO2+3H2↑(1分) 1mol/L (1分)
23、(八校)下表是元素周期表的一部分,表中所列字母分别代表一种元素。
|
a |
|
|
|||||||||||||||
|
|
|
|
|
b |
c |
d |
e |
|
|||||||||
|
f |
|
g |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
i |
回答下列问题:
(1)以上指定元素形成的单质中,熔点最低的是________(填化学式);
(2)由a、c、d三种元素形成的化合物中,能促进水电离的是________(填其中一种物质的化学式),能抑制水电离的是_________(填其中一种物质的化学式)。
(3)e元素位于周期表中第____周期____族;b、c、d、e、h元素的氢化物中,热稳定性最大的是_____(填氢化物的化学式)。
(4)f、g元素的单质共5.0 g在100 mL水中完全反应,生成的溶液中只含有一种溶质分步写出发生反应的化学方程式:
① ②
所得溶液的物质的量浓度最大值为 。(液体的体积变化忽略不计)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com