
26、(1)气体发生装置 精确量取液体体积 (2)25.062 (3) AB
(4)① B 2分 ②B (5) AB
26. (普陀二)在常温常压下,可利用下列装置来测定气体体积
(1)写出装置名称:A 。C装置的作用是 。
(2)若称取0.113 g镁带跟10.00 mL稀硫酸(足量)完全反应制取氢气,并测定1 mol氢气的体积(在常温常压下测定)。反应结束时C中的液面刻度为128.00 mL,则得此条件下1 mol氢气的体积为 L(精确到0.001)。
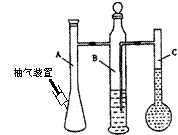 (3)上述测出1
mol氢气的体积比该温度和压强下的理论值偏高的原因是(假设操作和装置都无问题) (选填编号,下同)。
(3)上述测出1
mol氢气的体积比该温度和压强下的理论值偏高的原因是(假设操作和装置都无问题) (选填编号,下同)。
A.未冷却到室温 B.反应速率太快
C.未进行抽气操作 D.装置气密性不好
(4)若利用上述装置测定CO2的气体摩尔体积。
① B中所盛放的液体应为
A.饱和Na2CO3溶液 B.饱和NaHCO3溶液
C.水 D.澄清石灰水
② 仪器A中盛放的试剂应为____
A.大理石,浓盐酸 B.纯碳酸钠,稀硫酸 C.纯碳酸钙,稀硫酸 D.纯碳酸钠,稀盐酸
(5) 用以上装置测出的气体摩尔体积均比理论值大,你认为减小实验误差可行的措施是____
A.把A装置浸入盛水(常温)的水槽中 B.减小酸的浓度
C.把A装置浸入盛冰水的水槽中 D.增大酸的浓度
26.(1)气体发生器;CaCO3 + 2H+ → Ca2+ + H2O + CO2↑ (2)c (3)3;使B瓶中导管内外液面持平 (4)24.0 (3分) (5)a、c(2分)
26.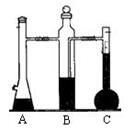 (金山二)以碳酸钙为原料,用化学反应气体体积测定仪(如图)来测定1 mol CO2的体积。回答下列问题:
(金山二)以碳酸钙为原料,用化学反应气体体积测定仪(如图)来测定1 mol CO2的体积。回答下列问题:
(1)图中仪器A的名称是_______________,其中发生反应的离子方程式为_______________________________
(2)B瓶中的液体最好选用_____(填编号)
a. 品红溶液 b. 饱和碳酸氢钠溶液 c. 用稀硫酸酸化的品红溶液
(3)完成一次测定实验,需要用____次注射器,其中最后一次是反应结束后,在A瓶的加料口处抽气,使_______________________________
(4)20℃时,实验测得的数据如下表:
|
碳酸钙的质量 |
1 mol·L-1盐酸的体积 |
液体量瓶中液体的体积 |
抽出气体的体积 |
|
0.460 g |
10.0 mL |
115.5 mL |
5.0 mL |
根据上述数据可以计算出该条件下1mol CO2的体积为_______ L(精确到0.1)
(5)下列情况会导致实验结果偏高的是______(填编号)
a. 碳酸钙中含有碳酸镁杂质 b. 储液瓶中的液体是水
c. 液体量瓶读数时俯视 d. 反应完成后未进行抽气,就读数
0.(2)酚酞(3)60(1分) (4)溶液由无色恰好变为红色,并在半分钟内不褪色(1分)
III.(1)第1次滴定误差明显大,属异常值,应舍去(1分) 0.75(1分) 4.5(1分)
(2)c(1分) (3)ab(2分)
26.I.(1) 滴定管(或10mL移液管)(1分) 烧杯 (1分) 容量瓶(1分)
26.(松江二)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
 (1)用_______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(1)用_______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴
作指示剂。
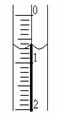
(3)读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。如果
液面位置如右图所示,则此时的读数为 mL。
(4)滴定。当 时,
停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
|
滴定次数 实验数据(mL) |
1 |
2 |
3 |
4 |
|
V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积 V = (15.95+15.00+15.05+14.95) /4 mL = 15.24mL。
指出他的计算的不合理之处: ________________________________。
按正确数据处理,可得c(市售白醋) = mol/L;市售白醋总酸量= g/100mL。
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 (填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
26.(1)CN-+ClO-→CNO-+Cl― ,2CNO-+6ClO―+8H+→N2↑+2CO2↑+3Cl2↑+4H2O
(2)浓硫酸, 除去Cl2 , 吸收CO2 , 防止空气中的CO2、水蒸气进入,干扰实验
(3)偏低,装置中残留有CO2未被完全吸收 (4)80%(2分)
26.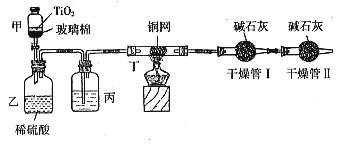 (浦东二)根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率。
(浦东二)根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率。
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出有关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。
丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅰ的作用是 ,干燥管Ⅱ的作用是 。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比 (填:“偏高”或“偏低”),简述可能的原因: 。
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为 。
27.(1)11.9 mol/L (1分)(2)250mL容量瓶(1分)、胶头滴管(1分); D(1分)
(3)将Fe2+氧化为Fe3+且不引入新的杂质(1分);
Fe3++3OH-→Fe(OH)3 ↓(1分) 、Al3++4OH-→AlO2-+2H2O(1分)
(4)取少量洗涤液于试管中,滴加几滴硝酸银溶液,若无沉淀,则已洗净(1分)
(5)恒重操作
(6)坩埚 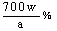 沉淀未洗净或沉淀物灼烧不充分)
沉淀未洗净或沉淀物灼烧不充分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com