
1、在25℃时,将0.05mol/L的盐酸与未知浓度的NaOH溶液以1∶2的体积比混合,所得溶液pH值为2。用上述NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0 mL,所得溶液pH值为10.
(1)c(NaOH) = (3分)
(2)c(HA) = (3分)
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:(已水解的物质的量/原来总物质的量)×100%。则上述所得NaA溶液的水解度(h)为
(4分)。
27、向一定量的Fe、FeO、Fe2O3的混合物中,加入100 mL 、1 mol·L-1的盐酸恰好使混合物完全溶解,放出224 mL (标准状况)的气体,所得溶液中加入KSCN 溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为多少?
26.向200 mL 0.6 mol·L-1的AlCl3 溶液中加0.4mol·NaOH溶液,结果得到了7.8 g 沉淀,则加入的0.4 mol·L-1的NaOH 溶液的体积可能是多少?

25、提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
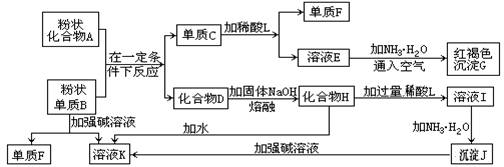 (1)单质F是_____________________。
(2) 溶液I中所含金属离子是_____________________。
(1)单质F是_____________________。
(2) 溶液I中所含金属离子是_____________________。
(3) 由C→E+F若改用浓酸,则不能选用的浓酸是(写名称)__________。 (4) 写出由E生成G的离子反应方程式(或化学方程式)________________。
24、喷泉是一种常见的自然现象,其产生原因是存在压强差。
右图(图1)为化学教学中用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。
(1)下列组合中不可能形成喷泉的是
A、HCl和H2O B、O2和H2O (图1)
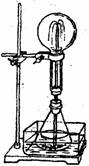 C、NH3和H2O
D、CO2和NaOH溶液
C、NH3和H2O
D、CO2和NaOH溶液
(2)某学生积极思考产生喷泉的其他办法,并设计了如右图(图2)所示的装置。
 ①在右下图(图2)的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
①在右下图(图2)的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A、Cu与稀盐酸 B、NaHCO3与NaOH溶液
C、 Na2SO3与稀硫酸 D、NH4HCO3与稀盐酸
②在右下图锥形瓶外有一水槽。锥形瓶中加有酒精,在水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。
水槽中加入的物质可以是 (图2)
A、浓硫酸 B、食盐 C、硝酸钾 D、硫酸铜
这种方法产生喷泉的原理是
③比较右上图(图1)和右下图(图2)两套装置,从产生喷泉的原理来分析, 右上图
是 上部烧瓶内气体压强;右下图是 下部锥形瓶内气体压强(均填增大或减小)。
(3)城市中常见的人造喷泉及火山爆发的原理与上述 (填图1或图2)装置的原理相似。
23、铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。
(1)配平制取铁酸钠的化学方程式:
Fe(NO3) 3 + NaOH + Cl2 ─ Na2FeO4 + NaNO3 + NaCl + H2O
 反应中 元素被氧化,转移电子总数为
反应中 元素被氧化,转移电子总数为
(2)铁酸钠之所以能净水,除了能消毒外,另一个原因是
22、若想用离子方程式:Fe + Cu 2+ = Fe2+ + Cu 所表示的反应设计出一个原电池,则该原电池的正极材料可选用 ;负极材料可选用 ;电解质溶液可选用 。
21、氮分子的电子式是___________。氨分子的结构式是___________,氨分子的空间构型为___________,氨分子是(填极性或非极性)_________分子。
20、把足量的铁粉投入到H2SO4和CuSO4的混合溶液中,充分反应后,残余固体与原来加入的铁粉质量相等,则原溶液中H+ 与SO42-的物质的量浓度之比为( )
A、1∶4 B、2∶7 C、1∶2 D、8∶31
19、24ml浓度为0.05 mol·L-1的Na2SO3溶液,恰好与20ml浓度为0.02mol·L-1的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
A、+6 B、+3 C、+2 D、0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com