
3.要得到函数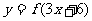 的图象,只需要把函数
的图象,只需要把函数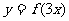 的图象
( )
的图象
( )
A.向左平移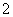 个单位
B.向右平移
个单位
B.向右平移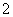 个单位
个单位
C.向左平移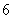 个单位 D.向右平移
个单位 D.向右平移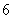 个单位
个单位
2.已知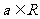 ,则“
,则“ ”是“
”是“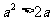 ”的
( )
”的
( ) 
A.充分不必要条件 B.必要不充分条件
C.充要条件 D.既不充分也不必要条件
1.已知全集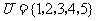 ,集合
,集合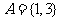 ,
,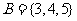 ,则集合
,则集合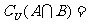 ( )
( )
A.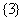 B.
B.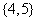 C.
C.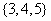 D.
D.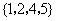

10.(05广东化学) 研究性学习小组进行SO2的制备及性质探究实验。
(1) 根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。
① 用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
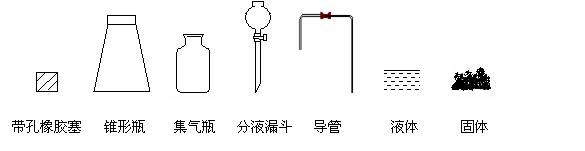

② 实验过程中,使用分液漏斗滴加浓硫酸的操作是___________________________。
(2) 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是_______________________________________________;
② 溴水溶液,现象是_______________________________________________;
③ 硫化钠溶液,现象是_______________________________________________。
(3) 有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
① 原因___________________________,验证方法__________________________________
_________________________________________________________________________________
② 原因___________________________,验证方法__________________________________
_________________________________________________________________________________
9.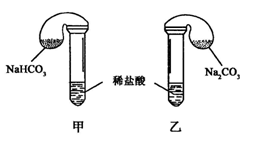 (05春北京)化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3,和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
(05春北京)化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3,和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
请回答:
(1) 各组反应开始时_____________,装置中的气球体积先变大,该装置中反应的离子方程式是___________________________________________。
(2) 当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
|
|
试剂用量 |
实验现象 |
分析原因 |
|
第①组 |
0.42 g NaHCO3 0.53 g N2CO3 3 mL 4 mol / L盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)= V乙(CO2) |
|
第②组 |
0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol / L盐酸 |
甲中气球比乙中气球的体积大 |
|
|
第③组 |
0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol / L盐酸 |
甲中气球比乙中气球的体积大 |
|
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示) |
8.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为______________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式__________________________________________
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是______________________
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
7.某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,设计如下方案:
|
|
操作 |
结论 |
|
甲 |
火柴梗 |
变黑者为浓硫酸 |
|
乙 |
加入金属铝片 |
产生刺激性气味者为浓硫酸 |
|
丙 |
分别加入到盛水的试管中 |
放热者为浓硫酸 |
|
丁 |
用玻璃棒蘸浓氨水靠近盛酸的瓶口 |
冒白烟者为浓梳酸 |
|
戊 |
加到CuSO4·5H2O晶体中 |
变白者为浓硫酸 |
(1)其中可行的是_________________。
(2)其中一个操作稍作改进就能成为可行的是__________,改进方法是___________________。
(3)完全错误的是_______,因为____________________________________________________。
(4)请给出另外两种鉴别方法
|
|
操作 |
根据现象做出结论 |
|
A |
|
|
|
B |
|
|
6.现有摩托车铅蓄电池的正负极标志模糊不清,某学生利用家里的用品判断电池的正、负极,他可利用的用品有:白醋、白酒、食盐、淀粉、自来水、碘酒、铜导线、铁钉、铝导线、小玻璃杯等,他利用上述物品如何鉴别电池的正、负极。
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
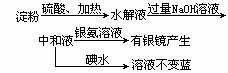
5.某学生设计了如下实验方案用以检验淀粉水解的情况:
下列结论正确的是( )
A.淀粉上有部分未水解 B.淀粉已完全水解
C.淀粉没有水解 D.淀粉已发生水解,但不知是否完全水解
4.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是( )
A.I、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
 C.Ⅱ装置中玻璃管内有水冷凝
C.Ⅱ装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com