
3.
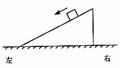 如图所示,一物体恰能在一个斜面体上沿斜面匀速下滑,设此过程中斜面受到水平地面的摩擦力为f1。若沿平行斜面方向用力向下推此物体,使物体加速下滑,设此过程中斜面受到地面的摩擦力为f2。则
如图所示,一物体恰能在一个斜面体上沿斜面匀速下滑,设此过程中斜面受到水平地面的摩擦力为f1。若沿平行斜面方向用力向下推此物体,使物体加速下滑,设此过程中斜面受到地面的摩擦力为f2。则
A. f1不为零且方向向右,f2不为零且方向向右
B. f1为零,f2不为零且方向向左
C. f1为零,f2不为零且方向向右
D. f1为零,f2为零
2. 河流不同位置水流速度不一定相同,若河水流速Vs随离一侧河岸距离变化的关系如图1(甲)所示,船在静水中的速度Vc与时间的关系如图1(乙)所示,则
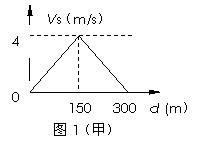
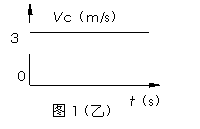
A.船的最短渡河时间为100s
B.船的最大行驶速度为5m/s
C.渡河的时间最短时, 船在水中沿直线斜向下游运动
D.渡河的时间最短时, 船头始终垂直与河岸
1. 伽利略在研究自由落体运动性质的时候,为了排除物体自由下落的速度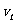 随着下落高度h(位移大小)是均匀变化(即:
随着下落高度h(位移大小)是均匀变化(即: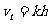 , k是常数)的可能性,设计了如下的理想实验:在速度为零的匀变速的直线运动中,因为
, k是常数)的可能性,设计了如下的理想实验:在速度为零的匀变速的直线运动中,因为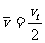 ①(
①(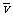 式中表示平均速度),而
式中表示平均速度),而
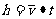 ②,如果
②,如果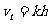 ③成立的话,那么,必有
③成立的话,那么,必有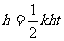 ,即:
,即: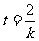 为常数.t竟然是h无关的常数!这显然与常识相矛盾!于是,可排除速度是随着下落高度h均匀变化的可能性.关于伽利略这个理想实验中的逻辑及逻辑用语,你做出的评述是
为常数.t竟然是h无关的常数!这显然与常识相矛盾!于是,可排除速度是随着下落高度h均匀变化的可能性.关于伽利略这个理想实验中的逻辑及逻辑用语,你做出的评述是
A.全部正确 B.①式错误 C.②式错误 D.③式以后的逻辑用语错误
21.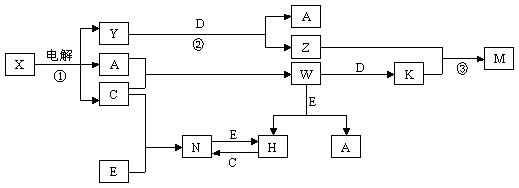 (12分)中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
(12分)中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
已知:A、B、C、D、E是单质,组成它们的元素的原子序数依次为a、b、c、d、e;且3(a + b) = 2(a + c) = 3(d -a),X、Y、Z、M、N、W、H、K是化合物,其中X是B和C的化合产物的水溶液。请回答下列问题:
(1)用电子式表示X中溶质的形成过程:_______________,组成C的元素的原子结构示意图是_____ 。
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式:
_______________________________________________________________。
(3)组成单质B、C、D的三种元素简单离子的离子半径由大到小的顺序是 _____ > ______ > ______(用离子符号表示)。
(4)写出K与过量的氨水反应的化学方程式 ;
写出M在水溶液中电离的方程式 。
20.(10分)某强酸性溶液X,含有Ba2+、Al3+、 SiO32-、NH4+、Fe2+、Fe3+、CO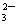 、SO
、SO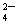 、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
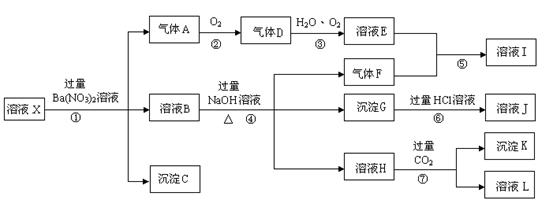
依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是: ,不能肯定的是: 。对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中根据现象就可判断,则该试剂最好是: ①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液
(2)气体F的结构式为: ,实验中,可以观察到反应②的现象是: 。
19.(10分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。
(1)写出A元素符号:A 。
(2)由A、B、C三种元素形成的化合物的电子式为 ,这种化合物形成的晶体中所含的化学键类型有 。
(3)A2B的沸点高于A2D,其原因是 。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是 (用离子方程式表示);
18.(10分)中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,A为常见强酸,则Y的电子式是 ,Y在工业或日常生活中的重要用途是 (举一例)。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是 (填所在周期和族)。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol。
17.(10分)10月11日,一中和田中进行了学业水平考试实验操作,试题分别为:Ⅰ.试验维生素C的化学性质(主要是还原性)。Ⅱ.葡萄糖与新制氢氧化铜的反应。Ⅲ.配制一定物质的量浓度的氯化钠溶液。
⑴、试题中设置了“评价与反思”,下列“评价与反思”科学合理的是 。(填序号)
A、应该由监考老师去评价与反思。B、实验结论告诉我:维生素C丸子应该密封保存。C、维生素C能使淀粉的碘溶液褪色。D、配制新制氢氧化铜时要将氢氧化钠与硫酸铜溶液等量混合。E、实验Ⅲ中玻璃棒的作用是搅拌和引流。F、实验Ⅱ中的废水应该回收后再集中处理,不能直接倒入下水道。
⑵、实验Ⅲ中合理的实验操作顺序是 。(填序号)
①溶解,②计算和称量,③转移和洗涤,④查漏,⑤定容和摇匀。
⑶、实验Ⅱ考查结束后,发现试管内壁附着一层红色固体,它的主要成分是 (写化学式),为了洗干净试管,某学习小组探究如何除去试管中的红色固体,设计了如下实验:①用蒸馏水反复洗刷,②加适量(3ml)稀硫酸,③加适量(3ml)稀硝酸,④用小刀刮下来。
用相同的待洗试管分别实验。按方法②进行后红色固体立即消失,溶液呈浅蓝色;按方法③进行后红色固体立即消失,溶液呈蓝色。以上四种实验方法中最好的是 (填序号)。写出实验③中反应的离子反应方程式 。
16.甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含l8个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是( )
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物
D.丁是一种不稳定的“绿色”氧化剂,则丁中一定含有-l价的元素
15、如图1,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )


|
选项 |
实验现象 |
解释 |
|
A |
浓盐酸附近产生白烟 |
NH3与浓盐酸反应产生了NH4Cl固体 |
|
B |
浓硫酸附近无明显现象 |
NH3与浓硫酸不发生反应 |
|
C |
氯化物溶液变浑浊 |
该溶液一定是AlCl3溶液 |
|
D |
干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 |
NH3是一种可溶性碱 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com