
6. 对下列曲线所表示生物意义的叙述中,错误的是
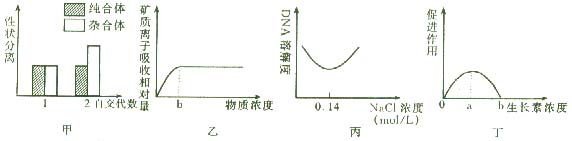
A.甲图正确表示了具有一对相对性状的杂合子植株自交l代后及自交2代后纯合子与杂合子的比例
B.由乙图可知,b点以后载体数量是限制根细胞吸收矿质离子的因素之一
C.由丙图可知,含DNA的黏稠物析出量不再增加时,溶液中NaCl的物质的量浓度相当于0.14 mol/L
D.由丁图中生长素浓度对植物芽生长的促进作用可知,a-b段生长素浓度对根的生长起抑制作用
5.今春,东南亚及其他国家爆发了大规模的禽流感,与前两年欧洲地区流行的疯牛病和口蹄疫一样,引起世界性的肉类食品进出口贸易恐慌。下列有关对禽流感的免疫学的看法,错误的是
A.抗体只能作用细胞外的抗原,而不能作用于细胞内的抗原
B.体液免疫对病原体通过血液循环的播散起抵制作用
C.人体可通过效应B细胞和效应T细胞产生抗体抵抗病原体
D.效应T细胞能激活靶细胞中的溶酶体酶和释放淋巴因子
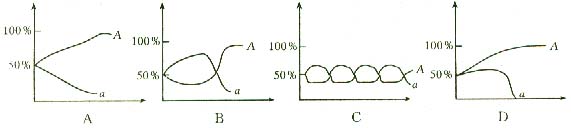
4. 如果基因型为Aa的个体自交产生的后代在某一环境中的生存能力或竞争能力是AA=Aa>aa,则在长期的选择过程中。下列能比较正确地表示A基因和a基因之间的比例变化的曲线是
3. 人工种子是指植物离体培养中产生的胚状体,包裹在含有养分和具有保护功能的物质中,并在适宜条件下能够发芽出苗的颗粒体。下列与人工种子形成过程无关的是
A.细胞的脱分化和再分化 B.细胞全能性
C.细胞有丝分裂 D.细胞减数分裂
2. 假设将一个精原细胞的一对同源染色体上的DNA分子用15N标记,并供给含14N的原料。该细胞进行减数分裂产生的4个精子中,含15N标记的DNA分子的精子所占比例为
A.100% B.50% C.25% D.0
1. 下列叙述中不正确的是
A.细胞核核膜对物质的通过具有选择性
B.若某男士表现出线粒体基因控制的疾病,则其女儿很可能会患此病
C.C4植物光合作用产物葡萄糖只在维管束鞘细胞的叶绿体内生成
D.用15N标记的蛋白质饲喂小鼠,则在其尿液中可检测到含15N的尿素
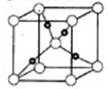
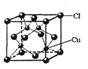
9.晶体微粒数与配位数的计算
铜的某种氯化物的晶胞结构如右图所示,其化学式为 ,其中Cl原子的配位数为_________
[典例2]下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
|
|
试填空。
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)元素③与⑧形成的化合物中元素③的杂化方式为: 杂化,其形成的化合物的晶体类型是:______________ _ _。
(3)元素④、⑤的第一电离能大小顺序是: > (用元素符号表示);元素④与元素①形成的X分子的空间构型为: 。请写出与N3-互为等电子体的分子、离子的化学式 , (各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式 。
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。

[典例3](09江苏)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2 等)与H2 混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
(2)根据等电子原理,写出CO分子的结构式 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2 的碱性溶液反应生成Cu2O 沉淀。
 ①甲醇的沸点比甲醛的高,其主要原因是
;
甲醛分子中碳原子轨道的杂化类型为
。
①甲醇的沸点比甲醛的高,其主要原因是
;
甲醛分子中碳原子轨道的杂化类型为
。
②甲醛分子的空间构型是 ;
1mol甲醛分子中σ键的数目为 。
③在1个Cu2O 晶胞中(结构如图所示),
所包含的Cu 原子数目为 。
[典例4](08江苏)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
[练习1]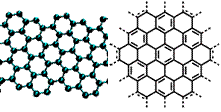 (2010盐城一模)美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用。石墨烯具有出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
(2010盐城一模)美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用。石墨烯具有出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
(1)下列有关石墨烯说法正确的是 。
A.石墨烯的结构与金刚石相似
 B.石墨烯分子中所有原子可以处于同一平面
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金 、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为: 。
②乙醇沸点比氯乙烷高,主要原因是 。
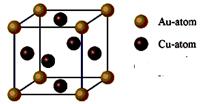
③右图是金与铜形成的金属互化物合金,它的化学式可表示为: 。
④含碳源中属于非极性分子的是 (a.甲烷 b.乙炔 c.苯 d.乙醇)
[练习2](2010泰州一模)铁是地球表面最丰富的金属之一,能形成多种配合物,铁系催化剂是工业生产中常用的催化剂。
⑴ 合成氨工业使用的催化剂是以铁为主体的多成分催化剂。
①NH3中N原子的杂化轨道类型是______________。
②N与O同属第二周期,N的第一电离能比O大的原因是 。
③根据等电子体原理,写出一种和NH4+是等电子体的微粒的化学式 。
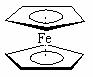 ⑵二茂铁[(C5H5)2Fe]
是一种金属有机配合物,是燃料油的添加剂,
⑵二茂铁[(C5H5)2Fe]
是一种金属有机配合物,是燃料油的添加剂,
用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它
的结构如右图所示,其中氢原子的化学环境完全相同。
①Fe的基态原子电子排布式为 。
②二茂铁中Fe2+与环戊二烯离子(C5H5-)之间的化学键类型是 。
 ③1mol环戊二烯(
③1mol环戊二烯( )中含有σ键的数目为
个。
)中含有σ键的数目为
个。
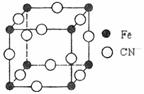
⑶ 普鲁士蓝俗称铁蓝,结构如右图所示(K+未画出),
每隔一个立方体在立方体中心含有一个K+离子,
普鲁士蓝中铁元素的化合价有+2和+3两种,其中
Fe3+与Fe2+的个数比为: 。
[练习3](2010扬州一模)超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:

试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有 。(填字母序号)
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子
C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素
D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体
(2)NH4CuSO3中的金属阳离子的核外电子排布式为 。
(3)SO32-离子中S硫原子的杂化方式为 ,与其互为等电子体的一种分子的分子式是 。
 (4)NH3易液化的原因是 。
(4)NH3易液化的原因是 。
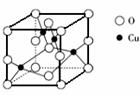
(5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为 。
(6)NH4CuSO3与硫酸微热反应的离子方程式为 。
8.常见晶体类型的判断、晶体熔沸点的比较
下表是A、B、C三种金属元素的电离能:
|
|
A |
B |
C |
|
第一电离能KJ/mol |
520 |
496 |
419 |
 已知A、B、C原子的价电子层的构型均为ns1,则该三种金属卤化物RX的熔点由高到低的顺序为
,理由是
已知A、B、C原子的价电子层的构型均为ns1,则该三种金属卤化物RX的熔点由高到低的顺序为
,理由是
7.范德华力与氢键
若X-含有10个电子,则X的氢化物的水溶液中存在 种不同形式的氢键
6.等电子体
写出与SO32-互为等电子体的一种分子的化学式 、与SCN-互为等电子体的一种离子的化学式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com